
【题目】3.04 g铜镁合金完全溶解于100mL密度为1.40gmL-1、质量分数为63%的浓硝酸中,得到NO2 和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.00 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。下列说法不正确的是
A.得到5.08g沉淀时,加入NaOH溶液的体积是600mL
B.该合金中铜与镁的物质的量之比是2:l
C.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
【答案】A
【解析】
铜镁合金与硝酸发生反应产生Cu(NO3)2、Mg(NO3)2,当向反应后的溶液中加入NaOH溶液后,金属阳离子变为Cu(OH)2、Mg(OH)2,所以变为沉淀增加的质量是OH-的质量,金属失去电子的物质的量与OH-的物质的量相等,等于硝酸变为NO2和N2O4得到电子的物质的量相等。
A. n(OH-)=(5.08g—3.04g)÷17g/mol=0.12mol,V(NaOH) =0.12mol÷2.00mol/L=0.06L=60mL,A错误;
B.假设合金中铜与镁的物质的量分别是x、y,则64x+24y=3.04g;2x+2y=0.12mol,解得x=0.04mol,y=0.02mol,所以x:y=2:1,B正确;
C.该浓硝酸中HNO3的物质的量浓度是C=![]() mol/L=14mol/L,C正确;
mol/L=14mol/L,C正确;
D.假设在混合气体中NO2和N2O4的物质的量分别是a、b。则根据电子守恒可得a+2b=0.12;a+b=2.24L÷22.4L/mol,解得a=0.08mol,b=0.02mol,所以混合气体中,NO2的体积分数是(0.08mol ÷0.12mol)×100%=80%,D正确。
故选A。


科目:高中化学 来源: 题型:
【题目】生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环已醇( ![]() )为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
)为原料制取己二酸[HOOC(CH2)4COOH]的实验流程如下:
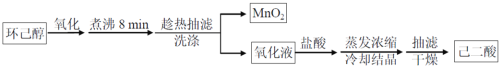
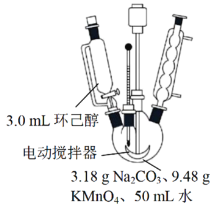
其中“氧化”的实验过程:在250mL四口烧瓶中加入50mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060mol)高锰酸钾,按图示搭好装置,打开电动搅拌,加热至35℃,滴加3.2mL(约0.031mol)环己醇,发生的主要反应为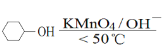 KOOC(CH2)4COOK ΔH<0
KOOC(CH2)4COOK ΔH<0
(1)“氧化”过程应采用___________加热。(填标号)
A.热水浴 B.酒精灯 C.煤气灯 D.电炉
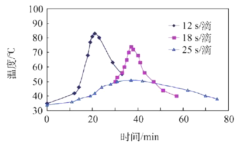
(2)“氧化”过程,不同环己醇滴加速度下,溶液温度随时间变化曲线如图,为保证产品纯度,应选择的滴速为___________s/滴。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到_____,则表明反应已经完成.
(4)“趁热抽滤”后,用________进行洗涤。
(5)室温下,相关物质溶解度如表。“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至__(填标号)。
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g 水 | 1.44 | 35.1 | 33.3 |
A.5mL B. 10mL C. 15mL D. 20mL
(6)称取已二酸(Mr=146g/mol)样品0.2920g,用新煮沸的50mL热水溶解,滴入2滴酚酞试液,用0.2000 mol/LNaOH溶液滴定至终点,进行平行实验及空白实验后,消耗NaOH的平均体积为19.70mL.
①NaOH溶液应装于_______ (填仪器名称).
②己二酸样品的纯度为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现取![]() 铝镁合金,使其在一定浓度的稀硝酸中恰好完全溶解
铝镁合金,使其在一定浓度的稀硝酸中恰好完全溶解![]() 假定硝酸的还原产物只有
假定硝酸的还原产物只有![]() ,向反应后的混合溶液中滴加
,向反应后的混合溶液中滴加![]() 溶液,当滴加
溶液,当滴加![]() 时,得到沉淀的质量恰好为最大值
时,得到沉淀的质量恰好为最大值![]() ,则下列有关说法不正确的是
,则下列有关说法不正确的是![]()
![]()
A.沉淀中氢氧根离子的质量为![]() B.恰好溶解后溶液中的
B.恰好溶解后溶液中的![]() 的物质的量为
的物质的量为![]()
C.生成标准状况下NO气体的体积为![]() D.与合金反应的硝酸的物质的量为
D.与合金反应的硝酸的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16 mol 充入 10 L 恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A.该温度下,此反应的平衡常数 K=1.44
B.4min 时,ν(逆)>ν(正)
C.反应前 2min 的平均速率 ν(Z)=2.0×10-3mol/(L·min)
D.7min 时,反应还未达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图像能直观地反映有关物理量的变化及规律,下列各图像与描述相符的是( )

A.图 1是其他条件一定时,反应速率随温度变化的图像,正反应 ΔH<0;
B.图 2 是一定条件下,向含有一定量 A 的容器中逐渐加入 B 时的图像,压强 p1>p2
C.图 3 表示分别稀释 1 mL pH=2 的盐酸和醋酸时溶液 pH 的变化,图中 b>100mL
D.图 4 表示平衡 2NO2(g) ![]() N2O4(g)在 t1 时迅速将体积缩小后 c(N2O4)的变化
N2O4(g)在 t1 时迅速将体积缩小后 c(N2O4)的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量与我们的健康息息相关,目前我国通过监测 6 项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2 和 CO 是其中 3 项中的污染物。
(1)一定温度下,向固定体积为 2 L 的密闭容器中充入 SO2 和 NO2 各 1 mol,发生反应SO2(g)+NO2(g) ![]() SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
SO3(g)+NO(g),测得上述反应 5 min 末到达平衡,此时容器中 NO 与 NO2的体积比为 3︰1,则这段时间内 SO2 的反应速率 v(SO2)=__________,此反应在该温度下的平衡常数 K=__________。
(2)甲醇日趋成为重要的有机燃料,通常利用 CO 和 H2 合成甲醇,其反应的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有 10 mol CO 和 20 mol H2用于合成甲醇。CO 的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:

①上述合成甲醇的反应为__________反应(填“放热”或“吸热”)。
②A、B、C 三点的平衡常数 KA、KB、KC 的大小关系为__________。A、B 两点对应的压强大小关系是 PA__________PB(填“大于”、 “小于”或“等于”)。
(3) 若将达到平衡状态A时生成的甲醇用于构成甲醇一氧气燃料电池,电解质溶液为KOH浓溶液,则该电池工作时正极的电极反应式为____________,理论上通过外电路的电子最多为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在-定体积的某密闭容器中发生合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
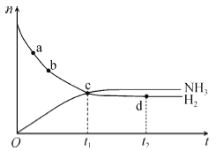
A.a点的正反应速率大于b点的
B.c点处,υ正(N2)=υ逆(N2)
C.d点处,υ正(N2):υ逆(H2)=1:3
D.升高温度,反应至t2时刻,n(H2)比图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾天气频繁出现,严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)![]() 2NO(g)△H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是________
2NO(g)△H>0。恒温,恒容密闭容器中,下列说法中能说明该反应达到化学平衡状态的是________
A.混合气体的密度不再变化
B.容器内的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的百分含量不再变化
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ·mol- 1
②洗涤含SO2的烟气。
写出焦炭与水蒸气反应的热化学方程式:________________________。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”之一。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质)。一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式________________;
②计算上述反应T1℃时的平衡常数K1=________;若T1<T2,则该反应的△H_______0(填“>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com