
【题目】在-定体积的某密闭容器中发生合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
2NH3(g) △H<0。673K,30MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述不正确的是( )
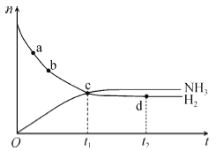
A.a点的正反应速率大于b点的
B.c点处,υ正(N2)=υ逆(N2)
C.d点处,υ正(N2):υ逆(H2)=1:3
D.升高温度,反应至t2时刻,n(H2)比图中d点的值大
【答案】B
【解析】
由图可知,随着反应的进行,反应物的量逐渐减少,生成物的量逐渐增多,达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,曲线水平,升高温度,平衡逆向移动,据此分析判断。
A. 从a点到b点,氢气的物质的量逐渐减少,浓度降低,所以正反应速率降低,即a点的正反应速率大于b点的正反应速率,A项正确;
B. c点处,n(H2)=n(NH3),但反应没有达到平衡状态,用N2表示的正、逆反应速率不相等,B项错误;
C. d点处达到平衡状态时,正反应速率等于逆反应速率,即υ正(N2):υ逆(H2)=1:3,C项正确;
D. 升高温度,平衡逆向进行,因此反应至t2时刻,n(H2)比图中d点的值大,D项正确;
答案选B。


 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】已知:![]() ,以下是用苯作原料制备一系列化合物的转化关系图:
,以下是用苯作原料制备一系列化合物的转化关系图:
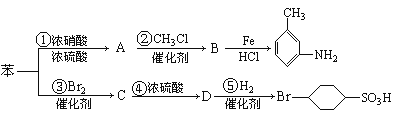
(1)苯转化为A的化学方程式是______________________________________________。
(2)B的结构简式为_______________。
(3)有机物C的所有原子______(填“是”或“不是”)在同一平面上。
(4)D分子苯环上的一氯代物有_________种。
(5)在上述反应①②③④⑤中,属于取代反应的是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.04 g铜镁合金完全溶解于100mL密度为1.40gmL-1、质量分数为63%的浓硝酸中,得到NO2 和N2O4的混合气体2240 mL(标准状况),向反应后的溶液中加入2.00 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。下列说法不正确的是
A.得到5.08g沉淀时,加入NaOH溶液的体积是600mL
B.该合金中铜与镁的物质的量之比是2:l
C.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH最小的是
A. NaOH (aq) + HCl (aq) ===NaCl (aq) + H2O (l) ΔH1
B. NaOH (aq) + ![]() H2SO4 (aq) ===
H2SO4 (aq) ===![]() Na2SO4 (aq) + H2O (l) ΔH2
Na2SO4 (aq) + H2O (l) ΔH2
C. CH3COOH (aq) + NaOH (aq) ===CH3COONa (aq) + H2O (l) ΔH3
D. NaOH (aq) + ![]() H2SO4 (浓) ===
H2SO4 (浓) ===![]() Na2SO4 (aq) + H2O (l) ΔH4
Na2SO4 (aq) + H2O (l) ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 下,下列酸的电离常数如下:
下,下列酸的电离常数如下:
化学式 |
| HCN |
|
电离常数 |
|
|
|
下列各项不正确的是![]()
A.往NaCN溶液中通入少量![]() :
:![]()
B.往碳酸钠溶液中加足量醋酸:![]()
C.多元弱酸的酸性由第一步电离决定,因为第一步电离产生的氢离子对下一步电离起抑制作用
D.等物质的量浓度的![]() 和NaCN溶液,NaCN溶液的碱性更强
和NaCN溶液,NaCN溶液的碱性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molA和2molB充入体积为2L的密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g) △H<0,5 min后达到平衡。已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化。下列选项不正确的是( )
C(g)+D(g) △H<0,5 min后达到平衡。已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化。下列选项不正确的是( )
A.a=1
B.升高温度,平衡常数减小
C.达平衡时B的转化率为60%
D.平衡后,若再加入2molB,重新平衡后,A的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对如表实验现象或操作的解释或结论错误的是![]()
编号 | 现象或操作 | 解释或结论 |
A | KI淀粉溶液中滴入氯水变蓝,再通入 |
|
B | 在 | 盐类水解反应是吸热反应 |
C | 向少量火柴头的浸泡溶液中滴加 | 火柴头里含有氯元素 |
D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向x mL 0.01 mol·L-1氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的pOH[pOH= -lgc(OH-)]、温度随着加入的硫酸溶液体积的变化如图所示,下列说法正确的是( )。
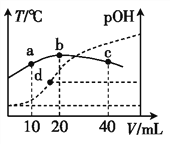
A. x=20
B. b点时溶液的pOH=pH
C. c点对应的溶液中:c(S![]() )>c(N
)>c(N![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. a、b、d三点NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性高锰酸钾溶液中通入SO2 | 溶液颜色褪去 | SO2具有漂白性 |
B | 将少量铜粉加入FeCl3溶液中 | 铜粉消失 | 还原性:Cu>Fe2+ |
C | 向溶液X中先滴加稀硝酸,再滴加氯化钡溶液 | 有白色沉淀生成 | 溶液X中含有SO |
D | 锌与稀硫酸反应制取氢气时,加入少量硫酸铜溶液 | 反应速率加快 | Cu2+起催化作用 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com