
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性高锰酸钾溶液中通入SO2 | 溶液颜色褪去 | SO2具有漂白性 |
B | 将少量铜粉加入FeCl3溶液中 | 铜粉消失 | 还原性:Cu>Fe2+ |
C | 向溶液X中先滴加稀硝酸,再滴加氯化钡溶液 | 有白色沉淀生成 | 溶液X中含有SO |
D | 锌与稀硫酸反应制取氢气时,加入少量硫酸铜溶液 | 反应速率加快 | Cu2+起催化作用 |
A.AB.BC.CD.D
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.30g乙烷所含共用电子对数目为6NA
C.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
D.1mol甲烷与氯气在光照下反应生成一氯甲烷分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚![]() ,其原理如图所示,下列说法不正确的是
,其原理如图所示,下列说法不正确的是
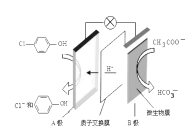
A.电流方向从B极沿导线经小灯泡流向A极
B.A为电池的正极,发生还原反应
C.A极的电极反应式为:![]()
D.当外电路中有0.2mole-转移时,进入A极区的H+的个数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
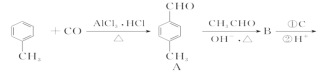

已知:HCHO+CH3CHO![]() CH2=CHCHO+H2O
CH2=CHCHO+H2O
(1)遇FeCl3溶液呈紫色且苯环上有两个取代基的A的同分异构体有_____________种,A中含官能团的名称为_______________________。
(2)试剂C可选用下列中的_________________。
a.溴水
b. 银氨溶液
c.酸性KMnO4溶液
d.新制Cu(OH)2悬浊液
(3) 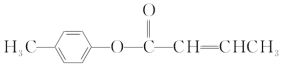 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________________________________________________。
(4)D的分子式为______________,由D→E的反应类型是_________________,E在一定条件下可以生成高聚物F,F的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中正确的是( )
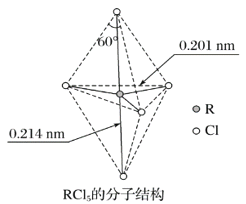
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D. 分子中5个R—Cl键键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 某溶液中可能存在
某溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等7种离子中的某几种,分别进行如下实验:
等7种离子中的某几种,分别进行如下实验:
![]() 向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
![]() 向所得橙色溶液中加入足量
向所得橙色溶液中加入足量![]() 溶液,无沉淀生成;
溶液,无沉淀生成;
![]() 向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
则下列说法正确的是![]()
A.肯定没有![]() B.肯定有
B.肯定有![]() 、
、![]()
C.可能有![]() D.可能有
D.可能有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可设计成原电池的化学反应是( )
A. H2O(l)+CaO(s)=Ca(OH)2(s)
B. Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
D. CH4(g)+2O2(g) ![]() CO2(g)+2H2O(l)
CO2(g)+2H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇、二甲醚(CH3OCH3) 既是重要的化工原料,又是可再生能源,具有开发和应用广阔前景。
(1)合成二甲醚的反应原理为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)。
CH3OCH3(g)+H2O(g)。
①该反应能够自发进行的原因是_______。
②若容器的体积恒定不变,CO、H2起始通入量分别为2 mol、4 mol,充分反应后达到平衡。下列措施既可以提高反应速率又可以提高CO的转化率是_______。
a.升高温度 b.使用更高效的催化剂
c.充入He,使体系总压强增大 d.缩小体积增大压强
(2)工业上合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-91 kJ·mol-1
CH3OH(g) ΔH=-91 kJ·mol-1
①已知某些化学键的键能数据如下表,则x=_______。
化学键 | C-H | H-H | C-O | C≡O | O-H |
键能/ kJ·mol-1 | a | b | c | x | d |
②在Ⅰ、Ⅱ、Ⅲ三个恒压容器中分别充入a mol CO和2a mol H2合成甲醇,三个容器的温度分别为T1、T2、T3。若实验测得反应均进行到t min时,三个容器中CO的体积分数如图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是_____。若反应达到平衡,三个容器中v(CH3OH)逆最大的是____。
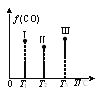
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A.硫酸铝溶液中加入过量氨水Al3++3OH- =Al(OH)3 ↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+![]() = CaCO3 ↓+2OH-
= CaCO3 ↓+2OH-
C.冷的氢氧化钠溶液中通入氯气Cl2 +2OH-=ClO-+H2O +Cl-
D.稀硫酸中加入铁粉2Fe + 6H+= 2Fe3++ 3H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com