
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,11.2L的戊烷所含的分子数为0.5NA
B.30g乙烷所含共用电子对数目为6NA
C.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
D.1mol甲烷与氯气在光照下反应生成一氯甲烷分子数为NA
【答案】C
【解析】
A.标准状况下,戊烷为液态,11.2L戊烷的物质的量远远大于0.5mol,其分子数远远大于0.5NA,A错误;
B.30g乙烷的物质的量=![]() =1mol,每个乙烷分子中含7对共用电子对,故30g乙烷所含共用电子对物质的量=1mol×7=7mol,即数目为7NA,B错误;
=1mol,每个乙烷分子中含7对共用电子对,故30g乙烷所含共用电子对物质的量=1mol×7=7mol,即数目为7NA,B错误;
C.乙烯、丙烯、丁烯的最简式均为CH2,它们的混合可看成由一定物质的量的CH2组成,且n(CH2)=![]() =1mol,n(原子)=1mol×3=3mol,即其原子数为3NA,C正确;
=1mol,n(原子)=1mol×3=3mol,即其原子数为3NA,C正确;
D.甲烷与氯气在光照条件下的反应涉及四个取代反应,四个反应几乎同时进行,根据C原子守恒可知,1mol甲烷与氯气在光照下反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷总共1mol,所以一氯甲烷分子数小于NA,D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】下列关于自然资源开发利用的说法错误的是
A.根据金属活泼性不同,冶炼金属采用的方法不同
B.通过煤的气化和液化等化学变化可将煤变为清洁能源
C.以石油、煤和天然气为原料可生产塑料、合成橡胶和合成纤维
D.从海带中提取碘经历的步骤有:灼烧![]() 浸泡
浸泡![]() 过滤
过滤![]() 萃取
萃取![]() 粗碘提纯
粗碘提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
①下列可判断反应达平衡状态的是___________(填序号字母)。
A. 混合气体的平均相对分子质量不变 B. 混合气体密度保持不变
C. NO和Cl2的物质的量之比保持不变 D. 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_________(填选项序号字母)。
A. 升高温度 B. 缩小容器体积 C. 再充入Cl2气体 D. 使用合适的催化剂
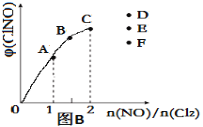
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(B)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是下图中D、E、F三点中的________点。
(2) 在体积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
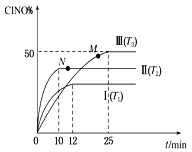
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是__________________。
②实验Ⅲ反应至25 min达到平衡,用NO物质的浓度变化表示的反应速率为__________________。达到平衡时,若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 4A(s)+3B(g)![]() 2C(g)+D(g),经2min 后,B的浓度减少了0.6molL-1。下列反应速率的表示正确的是( )
2C(g)+D(g),经2min 后,B的浓度减少了0.6molL-1。下列反应速率的表示正确的是( )
A.用A表示的反应速率是 0.4 mol·L-1·min-1
B.2min末时的反应速率,用B表示为0.3 mol·L-1·min-1
C.用 B 表示的平均反应速率是0.3 mol·L-1·min-1
D.在这 2 min 内,用 B 表示的反应速率的值是减小的,用 C 表示的反应速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某研究小组探究SO2和Fe(NO3)3溶液的反应。已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
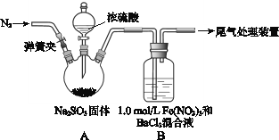
(1)装置A中发生的化学方程式为________________。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是___________。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是____,说明SO2具有______性。
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与NO3-反应;
基于观点1,装置B中反应的离子方程式是______________,为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足)________。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是____(填序号)。
A. 0.1 mol·L-1的稀硝酸
B. 1.5 mol·L-1的Fe(NO3)3溶液
C、6.0 mol·L-1的NaNO3和0.2 mol·L-1盐酸等体积混合的混合液
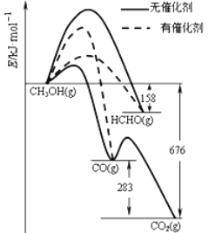
II、(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH与O2发生反应时生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
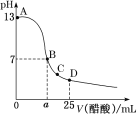
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 用含a的代数式表示CH3COOH的电离常数K=2.5×10—7/(0.2a-2.5)
C. C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Cu(s)+2H+(aq)===Cu2+(aq)+H2(g) ΔH1
2H2O2(l)===2H2O(l)+O2(g) ΔH2
2H2(g)+O2(g)===2H2O(l) ΔH3
则反应Cu(s)+H2O2(l)+2H+(aq)===Cu2+(aq)+2H2O(l)的ΔH是
A. ΔH=ΔH1+1/2ΔH2+1/2ΔH3 B. ΔH=ΔH1+1/2ΔH2-1/2ΔH3
C. ΔH=ΔH1+2ΔH2+2ΔH3 D. ΔH=2ΔH1+ΔH2+ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 向酸性高锰酸钾溶液中通入SO2 | 溶液颜色褪去 | SO2具有漂白性 |
B | 将少量铜粉加入FeCl3溶液中 | 铜粉消失 | 还原性:Cu>Fe2+ |
C | 向溶液X中先滴加稀硝酸,再滴加氯化钡溶液 | 有白色沉淀生成 | 溶液X中含有SO |
D | 锌与稀硫酸反应制取氢气时,加入少量硫酸铜溶液 | 反应速率加快 | Cu2+起催化作用 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com