
【题目】(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
①下列可判断反应达平衡状态的是___________(填序号字母)。
A. 混合气体的平均相对分子质量不变 B. 混合气体密度保持不变
C. NO和Cl2的物质的量之比保持不变 D. 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_________(填选项序号字母)。
A. 升高温度 B. 缩小容器体积 C. 再充入Cl2气体 D. 使用合适的催化剂
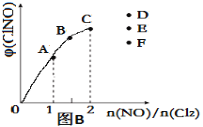
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(B)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是下图中D、E、F三点中的________点。
(2) 在体积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
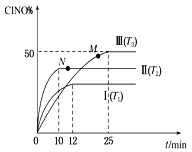
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是__________________。
②实验Ⅲ反应至25 min达到平衡,用NO物质的浓度变化表示的反应速率为__________________。达到平衡时,若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为________。
【答案】AC BC F 加入催化剂 0.008 mol·(L·min)-1 2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH = -Q KJ/mol
2ClNO(g) ΔH = -Q KJ/mol
【解析】
(1)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的其它物理量不变;
②提高NO的转化率即改变条件反应正向进行,提高反应速率可采取增大浓度、升高温度、加入催化剂、压缩气体,综合两方面解答;
③当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当![]() =2.5时产物的含量减小;
=2.5时产物的含量减小;
(2) ①结合影响反应速率和平衡移动的常见因素温度、压强和催化剂分析;
②实验Ⅲ反应至25 min达到平衡 2NO(g)+Cl2(g)![]() 2ClNO(g)
2ClNO(g)
起始浓度(mol/L) 0.3 0.2 0
变化浓度(mol/L) 2c c 2c
起始浓度(mol/L) 0.3-2c 0.2-c 2c
平衡时ClNO%的含量为50%,则![]() 100%=50%,c=0.1,根据v=
100%=50%,c=0.1,根据v=![]() 计算用NO物质的浓度变化表示的反应速率;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,由此写出该反应的热化学方程式。
计算用NO物质的浓度变化表示的反应速率;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,由此写出该反应的热化学方程式。
(1)①A.反应2NO(g)+Cl2(g)![]() 2ClNO(g)是体积变化的反应,反应正向进行则气体总物质的量n减小,逆向进行则气体总物质的量n增大,体系中物质总质量m不变,结合M=
2ClNO(g)是体积变化的反应,反应正向进行则气体总物质的量n减小,逆向进行则气体总物质的量n增大,体系中物质总质量m不变,结合M=![]() 可知,M不变则各物质的物质的量不变,反应达到平衡状态,故A正确;
可知,M不变则各物质的物质的量不变,反应达到平衡状态,故A正确;
B.反应体系是恒容,各物质均为气态,所以气体的总质量不变,根据ρ=![]() 可知,体系中混合气体密度始终不变,即混合气体密度不变不能判定反应是否达到平衡,故B错误;
可知,体系中混合气体密度始终不变,即混合气体密度不变不能判定反应是否达到平衡,故B错误;
C.起始投入的NO与Cl2的物质的量之比是1:1,而变化的NO与Cl2的物质的量之比是2:1,所以在未达平衡前,NO与Cl2的物质的量之比是变化的,当NO与Cl2的物质的量之比保持不变时,反应达到平衡状态,故C正确;
D.v(ClNO)正=v(NO)正时,反应正向进行,不能确定是否达到平衡状态,故D错误;
故答案为AC;
②A.升高温度,反应速率加快,平衡会移动,但不知道反应的热效应,无法确定平衡移动的方向,故A错误;
B.缩小容器体积,相当加压,反应正向进行、反应速率加快,故B正确;
C.充入Cl2气体,反应速率加快、反应正向进行,NO的转化率提高,故C正确;
D.使用合适的催化剂,能加快反应速率,但不影响反应移动方向,即NO的转化率不变,故D错误;
故答案为BC;
③当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当![]() =2.5时ClNO的体积分数减小,所以应该是F点;
=2.5时ClNO的体积分数减小,所以应该是F点;
(2) 根据ClNO的百分含量随时间的变化的图示,T1>T2>T3,则升高温度,ClNO%不断减小,平衡逆向移动,说明正反应放热,即ΔH<0;
①与实验Ⅰ相比,实验Ⅱ的反应温度T2<T1,如果其它条件相同,实验Ⅱ达到平衡所需要的时间应该比实验Ⅰ长,而图示实验Ⅱ达到平衡所需要的时间应该比实验Ⅰ短,实验Ⅱ的反应速率快,则可能使用了催化剂;
②实验Ⅲ反应至25 min达到平衡

平衡时ClNO%的含量为50%,则![]() 100%=50%,c=0.1,则用NO物质的浓度变化表示的反应速率v(NO)=
100%=50%,c=0.1,则用NO物质的浓度变化表示的反应速率v(NO)=![]() =
=![]() =0.008 mol·(L·min)-1;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,则该反应的热化学方程式为2NO(g)+Cl2(g)
=0.008 mol·(L·min)-1;达到平衡时,Cl2的变化量为0.1mol/L×10L=1mol,反应放出QkJ能量,则该反应的热化学方程式为2NO(g)+Cl2(g)![]() 2ClNO(g) ΔH = -Q KJ/mol。
2ClNO(g) ΔH = -Q KJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在200 ℃,将1 mol H2(g)和2 mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH=-c kJ/mol
2HI(g) ΔH=-c kJ/mol
(1)反应刚开始时,由于c(H2)=______ mol/L,c(I2)=______mol/L,而c(HI)=_____,所以化学反应速率 _______最大,而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____,c(I2)_____,而c(HI)________,从而化学反应速率v(正)______,而v(逆)_____。(以上填“增大”“减小”或“不变”)
(3)当反应进行到v(正)与v(逆)_______时,此可逆反应就达到了平衡。若保持外界条件不变时,反应混合物的总物质的量为_______mol。此时放出的热量Q_______(填“>”“<”或“=”)c kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
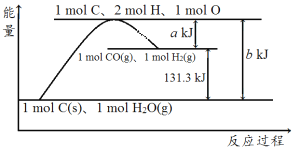
A.反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.amol C和amol H2O(l)反应生成amol CO和a mol H2吸收的热量一定为131.3a kJ
D.1mol C、2mol H、1mol O转变成1mol CO(g)和1mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读材料,完成下列问题。
海底盐池是近些年海洋科学家的一项重要发现,分布在世界多处埋有盐层的海域,目前人类已探明的海底盐池主要分布在红海、地中海、墨西哥湾、黑海、南极大陆架。盐池池面与普通海水之间有着清晰可见的分界。数不清的贝类与鱼虾在波光粼粼的盐池周围生活,但一旦生物进入盐池内就会死亡。研究人员还从盐池中采集了可以适应池中环境的生物样本,分析之后认为这类生物可能会在太阳系中某一行星上生存,甚至可能在太阳系之外也会存在。
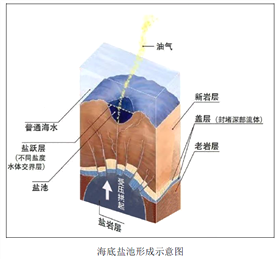

(1)结合材料,分析海底盐池的形成条件。
(2)简析池面与普通海水之间有明显分界的原因。
(3)推测生物一旦进入这个海底盐池就会死亡的原因。
(4)“海底盐池”会受到哪些领域专家的关注,并简述对“海底盐池”开展科考的现实意
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g·cm-3)配制250 mL0.4 mol·L-1稀硫酸,有以下实验仪器供选:A 10mL量筒 B 托盘天平 C 玻璃棒 D 250 mL容量瓶 E 500 mL容量瓶 F 胶头滴管 G. 烧杯
(1)需量取浓硫酸的体积为___________mL。
(2)实验时不可选用的仪器有(填序号) __________________。
(3)配制过程中,下列情况会使配制结果偏高的是_____(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配置过程中,实验操作步骤为: __________
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中。
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸。
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:

①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA
B. 100g CaCO3晶体和100g KHSO4晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO和2.24L O2混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O=HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com