
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:

①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
【答案】 2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)△H =-204.7kJ·mol-1 压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,另外压强升高使CO和H2浓度增加,反应速率增大 c(CH3OH)c(H2O)/c(CO2)c3(H2) CH3OCH3+3H2O-12e-=2CO2+12H+ Fe-2e-=Fe2+ Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O 6.4×10-7mol/L 是
【解析】(1)(i)CO(g)+2H2(g)==CH3OH(g)△H1=-90.1kJ·mol-1; (iv)2CH3OH(g)==CH3OCH3(g)+H2O(g)△H4=-24.5kJ·mol-1;根据盖斯定律:i×2+iv得到:2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)△H =-204.7kJ·mol-1;该反应是气体体积减小的反应,增加压强平衡正向进行,反应速率增大,CO和H2转化率增大,CH3OCH3产率增加,另外压强升高使CO和H2浓度增加,反应速率增大;正确答案: CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)△H =-204.7kJ·mol-1;压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,另外压强升高使CO和H2浓度增加,反应速率增大。
②(ii)CO2(g)+3H2(g)== CH3OH(g)+H2O(g)△H2=-49.0kJ·mol-1;反应(ii)的平衡常数表达式为K=c(CH3OH)c(H2O)/c(CO2)c3(H2);正确答案:c(CH3OH)c(H2O)/c(CO2)c3(H2)。
(2) ①根据氢离子移动方向,M电板为原电池的负极,甲醚发生氧化反应产生CO2,电极反应式为:CH3OCH3+3H2O-12e-=2CO2+12H+;金属铁做阳极,失电子,发生氧化反应, 电极反应式为:Fe-2e-=Fe2+;正确答案:CH3OCH3+3H2O-12e-=2CO2+12H+;Fe-2e-=Fe2+。
②阳极铁失电子变为亚铁离子,具有还原性,被Cr2O72-氧化为铁离子,Cr2O72-本身还原为Cr3+,离子反应方程式: Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O;正确答案:Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
③当溶液的pH=6时,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,Ksp[Cr(OH)3]= c(Cr3+)×c3(OH-)=6.4×10-31, c(Cr3+)=6.4×10-31/(10-8)3=6.4×10-7mol/L,如果以离子浓度≤1×10-5mol/L作为该离子除尽的标准,6.4×10-7mol/L<1×10-5mol/L,Cr3+是被除尽;正确答案:6.4×10-7mol/L ;是。


科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
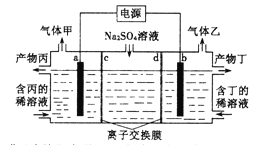
A. a电极反应式为:2H++2e—=H2↑ B. 产物丙为硫酸
C. d为阴离子交换膜 D. Na2SO4溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
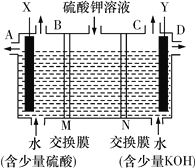
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________________________________________。
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸________ mol,正极板质量增加______g,负极板质量增加________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示盐碱地呈碱性的原因:____________________________________。
(2)已知水存在平衡2H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍,稀释后pH仍相等,则m________ n(填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,由水电离出来的c(OH-)=________mol·L-1。
(5)已知:常温下,NH3·H2O的电离平衡常数Kb=1.75×10-5,H2CO3的电离平衡常数Ka1和Ka2分别为4.4×10-7和5.6×10-11, 依据上述Kb>__________(填“Ka1” 或“ Ka2”)可推知NH4HCO3溶液的酸碱性是________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用FeSO4和NaOH为主要原料、在碱性条件下通入空气氧化沉淀制备铁磁粉Fe3O4,其原理如下:
①FeSO4 +2NaOH==Fe(OH)2↓ +Na2SO4
②4Fe(OH)2+O2 +2H2O= =4Fe(OH)3↓
③Fe(OH)2+2Fe(OH)3![]() Fe3O4+4H2O
Fe3O4+4H2O
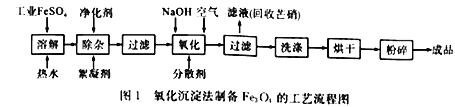
硫酸亚铁在不同温度下的溶解度:
温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
I.(问题讨论)
(1)溶解时,所用热水的温度约为___________,目的是_______________________________________。
(2)副产品芒硝的化学式是_______________________。
(3)为了检验产品是否洗涤干净,需要进行的实险操作是________________________________。
II.(组成确定)
资料显示:①铁的氯氧化物在受热时分解生成铁的氧化物(化合价不变);
②Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4 ,再生成FeO(黑色),最后生成Fe。
为确定用以上方法制得的产品的纯度,称取23.28g该样品利用图2装置进行实验探究。
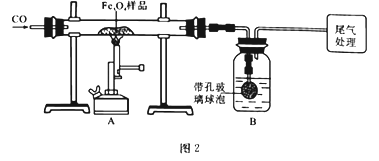
(1)该组同学欲通过称量B装置反应前后的质量变化来计算并确认该样品中的杂质。B中的最佳试剂是________(填字母),B中带孔玻璃球泡的作用是____________________________________。
A.澄清石灰水 B.氢氧化钠浓溶液 C.稀盐酸 D.水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用还有:
①实验开始时,排尽装置中的空气,防止加热时发生爆炸;
②停止加热后,继续通CO气体,防止生成物被氧化,防止B中的溶液倒吸入A中,还可以_______,以提高实验的精确度。
(3)利用仪器测定并绘制出反应过程中A装置中玻璃管内的固体质量随温度的变化曲线,如图3:

①样品中含有的杂质成分是_____________________(填化学式)。
②样品中杂质的质量分数为_____ %(保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1:1
B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等
C. Na2O2与CO2反应过程中,只做氧化剂
D. Na2O2与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是( )
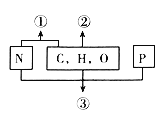
A. 若①是某种大分子的基本组成单位,则①是氨基酸
B. 若②是生命活动的主要能源物质,则②是糖类
C. 若②是细胞中的储能物质,则②一定是脂肪
D. 若③是携带遗传信息的大分子物质,则③一定是核酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com