
【题目】某同学用下图装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
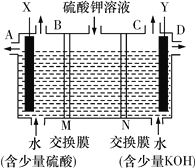
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________________________________________。
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸________ mol,正极板质量增加______g,负极板质量增加________g。
【答案】 正 C 阴离子 阳离子 增强溶液导电性 H2-2e-+2OH-===2H2O 1 32 48
【解析】目的是用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾,由装置图可知,硫酸应在左室得到,KOH在右室得到,左室为阳极室,氢氧根离子放电生成氧气,M为阴离子交换膜,硫酸根离子通过阴离子交换膜进入左室,右室为阴极室,氢离子放电生成氢气,N为阳离子交换膜,钾离子通过阳离子交换膜进入右室。则
(1)左室为阳极室,X极与电源正极相连,右室为阴极室,氢离子放电生成氢气,氢气从C口导出。(2)由上述分析可知,M为阴离子交换膜,N为阳离子交换膜。硫酸与氢氧化钾均是强电解质,图中少量硫酸和少量氢氧化钾的作用是增强溶液导电性;(3)将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2-2e-+2OH-=2H2O;(4)生成氢气物质的量为11.2L÷22.4L/mol=0.5mol,转移电子为0.5mol×2=1mol。铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l),所以理论上铅蓄电池消耗硫酸1mol,正极板发生反应:PbO2(s)+2e-+4H+(aq)+SO42-aq)=PbSO4(s)+H2O(l),所以正极板质量增加0.5mol×303g/mol-0.5mol×239g/mol=32g,负极板反应为Pb(s)-2e-+SO42-(aq)=PbSO4(s),质量增加0.5mol×96g/mol=48g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 氨水 | 食盐水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化铁 | 家用食醋 | 硫酸钡 | 碳酸 | 蔗糖 |
C | 胆矾 | 碘酒 | 苛性钠 | 碳酸 | 碳酸钙 |
D | 盐酸 | 氯化钾溶液 | 氯化钠 | 氢氧化铜 | 氢气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NO2和N2O4可以相互转化N2O4 (g)![]() 2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
2NO2 (g)△H=+57.2kJ/mol。t℃时,现将一定量NO2和N2O4的混合气体通入体积为2 L的恒温密闭容器中,反应物浓度随时间变化关系如下表所示,据此回答相关问题:
时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
c(x)/mol·L-1 | 0.2 | C | 0.6 | 0.6 | 1.2 | C1 | C1 |
c(Y)/mol·L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | C2 | C2 |
①前10 min内用N2O4表示的化学反应速率v(N2O4)=__________,t℃时,该反应的化学平衡常数K=__________。
②20min时,若只改变了某一个条件,该条件可能是__________。
③t℃时,若开始时向容器中充入1mol的NO2、0.2mol N2O4,则v(正)________v(逆)(填“>”“<”或“=”)
(2)一定压强下,向10L密闭容器中充入1molS2Cl2和1molCl2,发生反应S2Cl2(g) + Cl2(g)![]() 2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
2SCl2(g)。Cl2和SCl2的消耗速率(v)与温度(T)的关系如图所示:
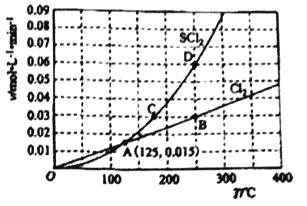
①ABCD四点对应状态下,达到平衡状态的有__________。
②△H2_______0(填“>”“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图所示实验装置(夹持仪器己略去)探究铜丝与过量浓硫酸的反应.下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的产生与停止
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认有CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)B、D的元素名称分别为:_____、_____;
(2)E在周期表中的位置为:_____,
(3)C离子的结构示意图为:_____;
(4)B、C、D三种元素的原子半径从大到小的顺序为_____(用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____(用对应的化学式表示)
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:_____;
(7)写出E与水反应的离子方程式:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种环保型塑料,其合成路线如下:

已知:①
② (R1、R2、R3、R为烃基)
(R1、R2、R3、R为烃基)
请回答下列问题:
(1)A中官能团的名称是____________,检验该官能团的试剂为___________________。
(2)反应①的化学方程式是:______________________________,其反应类型为________________,在反应①中,还可以得到另一种分子式为C10H16的化合物,其结构简式为___________________。
(3)已知,![]() 名称为丙酮酸,则C的系统命名法命名应为____________________。
名称为丙酮酸,则C的系统命名法命名应为____________________。
(4)写出反应④的化学方程式:______________________________。
(5)C的同分异构体X满足下列条件:
①常温下,与碳酸钠溶液反应放出气体;
②能发生银镜反应。则符合条件的X共有________种。其核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则X的结构简式为________________。
(6)参照E的上述合成路线,设计一条由4一甲基一3一戊酮酸为起始原料制备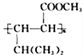 的合成路线(无机试剂任选)_________________________________________。
的合成路线(无机试剂任选)_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)由工业合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,涉及以下四个可逆反应:
甲醇合成反应:
(i)CO(g) +2H2(g)==CH3OH(g) △H 1=-90.1kJ·mol-1;
(ii)CO2(g)+3H2(g)== CH3OH(g) +H2O(g) △H2=-49.0kJ·mol-1;
水煤气变换反应:(iii)CO(g)+ H2O(g)==CO2(g)+ H2(g) △H3=-41.1kJ·mol-1;
二甲醚合成反应:(iv)2CH3OH(g) ==CH3OCH3(g)+ H2O(g) △H4=-24.5kJ·mol-1;
①由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为____________________________。根据化学反应原理,分析增大压强对直接制备二甲醚反应的影响:___________________________________。
②反应( ii )的平衡常数表达式为K=______________。
(2)现以二甲醚燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72-),实验室利用如图2装置模拟该法:

①M电板(a为CO2)的电极反应式为________________________;电解池阳极的电极反应式为_______________________________________。
②请写出电解池中Cr2O72-转化为Cr3+的离子反应方程式:__________________________。
③已知25 ℃时,Ksp[Cr(OH)3]=6.4×10-31。一般以离子浓度≤1×10-5 mol/L作为该离子除尽的标准。处理废水时,最后Cr3+以Cr(OH)3形式除去,当溶液的pH=6时,c(Cr3+)=______,Cr3+ ___ (填“是”或“否”)被除尽。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的名称或俗名与化学式相对应的是
A.小苏打——Na2CO3B.火碱——Na2O2
C.生石灰——Ca(OH)2D.醋酸——CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com