
【题目】下列各组混合物中,能用分液漏斗进行分离的是( )
A.酒精和水
B.四氯化碳和水
C.汽油和植物油
D.碘和四氯化碳
科目:高中化学 来源: 题型:
【题目】下列有关物质分类的叙述正确的是
A.CaCl2、NaOH、HCl、O2四种物质都属于化合物
B.溶液、浊液、胶体都属于混合物
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.CO2、CO等非金属氧化物均属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解硫酸钠溶液生产硫酸和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
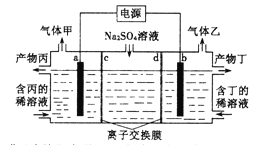
A. a电极反应式为:2H++2e—=H2↑ B. 产物丙为硫酸
C. d为阴离子交换膜 D. Na2SO4溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是

A. 以铅蓄电池为电源,则a极为Pb电极
B. 石墨Ⅱ电极附近的pH逐渐减小
C. 阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D. 每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________,将溶液调至pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________ mol·L-1。
(2)上述溶液过滤后,将所得滤液经过________、________(按操作顺序填写实验步骤的名称),再经过滤,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入适当过量的KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I- )。
+2I- )。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③含有CuCl2·2H2O晶体的试样的纯度是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
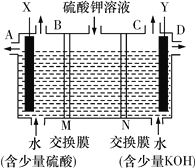
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________________________________________。
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸________ mol,正极板质量增加______g,负极板质量增加________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示盐碱地呈碱性的原因:____________________________________。
(2)已知水存在平衡2H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍,稀释后pH仍相等,则m________ n(填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,由水电离出来的c(OH-)=________mol·L-1。
(5)已知:常温下,NH3·H2O的电离平衡常数Kb=1.75×10-5,H2CO3的电离平衡常数Ka1和Ka2分别为4.4×10-7和5.6×10-11, 依据上述Kb>__________(填“Ka1” 或“ Ka2”)可推知NH4HCO3溶液的酸碱性是________性。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com