
【题目】已知有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,B、C组成的某一种化合物能引起温室效应.常温下,金属D单质投入水中能与水剧烈反应.常温下E单质是常见的气体.请按要求回答下列几个问题:
(1)B、D的元素名称分别为:_____、_____;
(2)E在周期表中的位置为:_____,
(3)C离子的结构示意图为:_____;
(4)B、C、D三种元素的原子半径从大到小的顺序为_____(用元素符号表示);
(5)B、E的最高价氧化物对应水化物的酸性从强到弱的顺序为:_____(用对应的化学式表示)
(6)写出C、D两种元素组成的阴、阳离子个数比为1:2且只含离子键的化合物的电子式:_____;
(7)写出E与水反应的离子方程式:_____.
【答案】碳 钠 第三周期第ⅤⅡA族 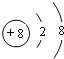 Na>C>O HClO4>H2CO3
Na>C>O HClO4>H2CO3 ![]() Cl2+H2O
Cl2+H2O![]() H++Cl﹣+HClO
H++Cl﹣+HClO
【解析】
A、B、C、D、E五种短周期的主族元素,它们的原子序数依次递增,A是所有元素中原子半径最小的元素,则A为氢元素,B、C组成的某一种化合物能引起温室效应,则B为碳元素,C为氧元素,常温下,金属D单质投入水中能与水剧烈反应,则D为钠元素,常温下E单质是常见的气体,E的原子序数大于钠,则E为氯元素,据此答题。
根据以上分析可知A为H,B为C,C为O,D为Na,E为Cl,则
(1)根据上面的分析可知,B、D的元素名称分别为碳元素和钠元素;
(2)E是氯元素,在周期表中位于第三周期第ⅤⅡA族;
(3)C为氧元素,氧离子的结构示意图为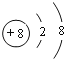 ;
;
(4)根据电子层数越多,半径越大,电子层数相同,核电荷数越多,半径越小,可知B、C、D三种元素的原子半径从大到小的顺序为Na>C>O;
(5)元素非金属性越强,对应的最高价氧化物对应水化物的酸性就越强,由于氯的非金属性强于碳,所以HClO4的酸性强于H2CO3;
(6)C、D两种元素组成的一种只有离子键的化合物为氧化钠,它的电子式为![]() ;
;
(7)氯气与水反应的离子方程式为Cl2+H2O![]() H++Cl﹣+HClO。
H++Cl﹣+HClO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】二甲醚是一种绿色、可再生的新能源。右图是绿色电源“二甲醚燃料电池”的工作原理示意图(a 、b均为多孔性Pt电极)该电池工作时,下列说法中正确的是
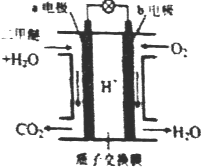
A. a电极为该电池正极
B. 电池工作时,燃料电池内部H+从b电极移向a电极
C. 电池工作时,b电极反应式:O2+4e-+2H2O=4OH-
D. 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O=2CO2↑+12H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是

A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入__________,将溶液调至pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________ mol·L-1。
(2)上述溶液过滤后,将所得滤液经过________、________(按操作顺序填写实验步骤的名称),再经过滤,可得到CuCl2·2H2O晶体。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入适当过量的KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I- )。
+2I- )。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为________________________________。
③含有CuCl2·2H2O晶体的试样的纯度是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下图装置电解硫酸钾溶液来获得氧气、氢气、硫酸和氢氧化钾。
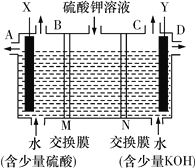
(1)X极与电源的________(填“正”或“负”)极相连,氢气从________(填“A”“B”“C”或“D”)口导出。
(2)离子交换膜只允许一类离子通过,则M为________(填“阴离子”或“阳离子”,下同)交换膜,N为________交换膜,图中少量硫酸和少量氢氧化钾的作用是________________________________________。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池负极的电极反应式为______________________________________________。
(4)若使用铅蓄电池作电源完成上述电解,当制得11.2 L标准状况下的氢气时,理论上铅蓄电池消耗硫酸________ mol,正极板质量增加______g,负极板质量增加________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质反应时,反应物用量或反应条件的改变对生成物无影响的是( )
A.C和O2B.Na2CO3和盐酸C.Na和O2D.NaHCO3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示盐碱地呈碱性的原因:____________________________________。
(2)已知水存在平衡2H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡________移动,所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别加水稀释m倍、n倍,稀释后pH仍相等,则m________ n(填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中,由水电离出来的c(OH-)=________mol·L-1。
(5)已知:常温下,NH3·H2O的电离平衡常数Kb=1.75×10-5,H2CO3的电离平衡常数Ka1和Ka2分别为4.4×10-7和5.6×10-11, 依据上述Kb>__________(填“Ka1” 或“ Ka2”)可推知NH4HCO3溶液的酸碱性是________性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。

(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。

①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上…其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.萃取B.洗气C.蒸馏D.干馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com