
【题目】室温下,pH 均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH 随溶液体积的变化曲线如图所示。下列说法正确的是

A. HA的酸性比HB的酸性弱
B. a点溶液的导电性比c点溶液的导电性弱
C. 若两溶液加水稀释,则所有离子的浓度都减小
D. 对a、b两点溶液同时升高温度,则c(A-)/c(B-)减小
【答案】D
【解析】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释至1000mL,HA溶液pH=5,说明HA为强酸,HB为弱酸;则A.pH均为2的两种一元酸HA和HB各1mL,分别加水稀释1000倍,HA溶液pH=5,HB溶液pH小于5,HA的酸性比HB的酸性强,A错误;B.a点溶液中离子浓度大于c点溶液中离子浓度,溶液导电性取决于离子浓度大小,则a点溶液的导电性比c点溶液的导电性强,B错误;C.溶液稀释氢离子浓度减小,而水的离子积Kw=c(H+)·c(OH-)不变,故c(OH-)增大,C错误;D.HA为强酸,HB为弱酸,对a、b两点溶液同时升高温度,c(A-)浓度不变,HB电离程度增大,c(B-)浓度增大,c(A-)/c(B-)比值减小,D正确;答案选D。


科目:高中化学 来源: 题型:
【题目】25℃时,向AgCl饱和溶液中加水,下列叙述正确的是
A. AgCl 的溶解度、Ksp均不变 B. AgCl 的溶解度、Ksp均增大
C. AgCl的溶解度增大 D. AgCl 的Ksp增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g) △H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是__________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程的变化曲线_____________。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO 通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如右图所示:

①有害气体NO的转化率为________, 0~15min NO的平均速率v(NO)=______mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将___________移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是____________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用物质的量浓度为0.100 0 mol·L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:

(1)用标准NaOH溶液滴定时,应将标准NaOH溶液注入_______(填“甲”或“乙”)中。
(2)某学生的操作步骤如下:
A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液;
D.取标准NaOH溶液注入碱式滴定管至“0”刻度以上 2~3 mL;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是____→___→___→___→A→___(用字母序号填写)。判断到达滴定终点的实验现象是_____________________________________
(3)右上图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______ mol·L-1。
(4)由于错误操作,使得上述所测盐酸溶液的浓度偏高的是________(填字母)。
A.中和滴定达终点时俯视滴定管内液面读数
B.酸式滴定管用蒸馏水洗净后立即取用25.00 mL待测酸溶液注入锥形瓶进行滴定
C.碱式滴定管用蒸馏水洗净后立即装标准溶液来滴定
D.用酸式滴定管量取待测盐酸时,取液前有气泡,取液后无气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是( )

A. a为负极、d为阳极
B. c电极上有气体产生,发生还原反应
C. 电解过程中,氯离子向d电极移动
D. 电解过程中,d电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中我们常用到铝制餐具。铝在空气中稳定存在的原因是( )
A.铝能产生铝热反应B.铝的化学性质不活泼
C.常温下铝不能与氧气反应D.铝表面能形成致密的氧化膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法。下列关于“CH3COOK”的分类不正确的是
A.化合物B.氧化物C.有机物D.钾盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是国民经济发展的重要基础,天然气是我国目前使用的主要能源。
(1)已知
化学键 | C-H | C=O | O=O | H-O |
E/(KJ/mol) | a | b | c | d |
CH4(g)+2O2(g)=CO2(g)+2H2O(g)的焓变ΔH=______kJ/mol。
(2)燃料电池具有高的发电效率,因而受到重视。下图甲为甲烷燃料电池(电解质溶液为硫酸)该电池的正极反应为_________。
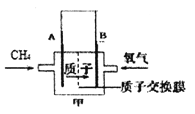
(3)利用上述燃料电池,按下图所示装置进行电解,A、B、C、D均为铂电极,
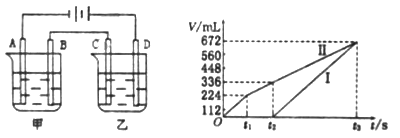
I.甲槽中有200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如上图所示(气体体积已换算成标准状况下的体积),(电解前后溶液的体积变化关系忽略不计)
①原混合溶液中NaCl的物质的量浓度__________mol/L。
②t2时所得溶液的pH=________。
Ⅱ.乙槽中为足量的AgNO3溶液。则阳极反应为__________。t3时电解结束,为了使溶液恢复原样,则可以在反应后的溶液中加入______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol NaHSO4熔融或溶于水时电离出的离子总数均为3NA
B. 17 g H2O2含有0.5NA个非极性共价键
C. 在1L0.5mol/LH2SO4溶液中,含有的氧原子数为2NA
D. 标准状况下,22.4 L Cl2溶于水转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com