
【题目】在200 ℃,将1 mol H2(g)和2 mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH=-c kJ/mol
2HI(g) ΔH=-c kJ/mol
(1)反应刚开始时,由于c(H2)=______ mol/L,c(I2)=______mol/L,而c(HI)=_____,所以化学反应速率 _______最大,而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____,c(I2)_____,而c(HI)________,从而化学反应速率v(正)______,而v(逆)_____。(以上填“增大”“减小”或“不变”)
(3)当反应进行到v(正)与v(逆)_______时,此可逆反应就达到了平衡。若保持外界条件不变时,反应混合物的总物质的量为_______mol。此时放出的热量Q_______(填“>”“<”或“=”)c kJ。
【答案】:![]() mol/L
mol/L ![]() mol/L 0 正反应速率 逆反应速率 减小 减小 增大 减小 增大 相等 3mol <
mol/L 0 正反应速率 逆反应速率 减小 减小 增大 减小 增大 相等 3mol <
【解析】
(1)反应刚开始时,由于c(H2)=![]() mol/L,c(I2)=
mol/L,c(I2)=![]() mol/L,而c(HI)=0,所以正反应速率最大,而逆反应速率最小(为零),
mol/L,而c(HI)=0,所以正反应速率最大,而逆反应速率最小(为零),
故答案为:![]() mol/L;
mol/L;![]() mol/L;0;正反应速率;逆反应速率;
mol/L;0;正反应速率;逆反应速率;
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)减小,c(I2)减小,而c(HI)增大,从而化学反应速率v正减小,而v逆增大,
故答案为:减小;减小;增大;减小;增大;
(3)当反应进行到v正与v逆相等时,此可逆反应就到了平衡;反应是气体体积不变的反应,若保持外界条件不变时,反应混合物的总物质的量为3mol。反应为可逆反应,不能反应彻底,此时放出的热量Q<c kJ。故答案为:相等;3mol;<。


科目:高中化学 来源: 题型:
【题目】 对此聚合物分析正确的是( )
对此聚合物分析正确的是( )
A. 其单体是CH2=CH2和HCOOC2H5
B. 它是缩聚反应产物
C. 其单体是CH2=CH-COOC2H5
D. 其链节是CH3CH2-COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.60 g纯铁粉加入适量稀硫酸中,固体完全溶解。加热条件下向反应液中先加入1.7 g NaNO3固体(已知NO3-在酸性条件下具有强氧化性),再通入448 mL Cl2(标准状况下,假设Cl2不逸出),产物中铁元素全部以Fe3+存在。(要求简要写出计算过程)
(1)被氯气氧化的Fe2+物质的量为________。
(2)NaNO3对应的还原产物中氮元素的化合价是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
![]() 已知
已知![]() 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量,![]() 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。
![]()
![]()
![]()
![]()
请写出制备水煤气的热化学方程式________。
![]() 恒容密闭容器中发生
恒容密闭容器中发生![]() 反应,当通入不同量的
反应,当通入不同量的![]() 和
和![]() 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:
实验组 | 温度
| 起始量
| 平衡量
| 达到平衡所需的时间 | ||
|
|
|
| |||
1 | 650 | 2 |
|
| 2 | 4 |
2 | 650 |
|
|
|
| 5 |
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时![]() ________mol/(Lmin)。
________mol/(Lmin)。
![]() 由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
![]() 若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。
若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。![]() 填编号
填编号![]()
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
![]() 取
取![]() 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
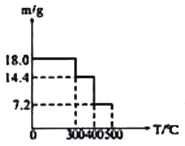
350℃时,固体的成分是________。
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为________。
③取350℃时的上述样品![]() 难溶于水
难溶于水![]() ,置入0.12mol/L、
,置入0.12mol/L、![]() 的酸性
的酸性![]() 溶液中,二者恰好反应,写出该反应的离子方程式________。
溶液中,二者恰好反应,写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯容易发生聚合生成二聚体,该反应为:![]() 。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )

A.T1>T2
B.a点的正反应速率小于b点的逆反应速率
C.a点的反应速率小于c点的反应速率
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、M、N四种有机物的有关信息如下表所示:
A | B | M | N |
比例模型为; | 球棍模型为: | 键线式结构为: | ①能与钠反应,但不能与NaOH溶液反应;②能与M反应生成相对分子质量为100的酯 |
请回答:
(1)A在一定条件下可合成包装塑料,反应的化学方程式为____________。
(2)在Ni作催化剂的条件下,B与氢气加热时反应的化学方程式为______________。
(3)M的分子式为__________,M与N反应的化学方程式为_______________。
(4)满足下列条件的M的同分异构体的结构简式为______________。
I:链状 ii:只含一种官能团 iii:能与新制氢氧化铜在加热条件下生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的乙烯,完全燃烧时放出的热量为Q,完全吸收燃烧后所生成的CO2气体需要200mL 2mol/L的NaOH溶液,则28g乙烯完全燃烧放出的热量不可能是
A. 5QB. 5Q~10QC. 10QD. 大于10Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
2ClNO(g) △H<0,一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应。
①下列可判断反应达平衡状态的是___________(填序号字母)。
A. 混合气体的平均相对分子质量不变 B. 混合气体密度保持不变
C. NO和Cl2的物质的量之比保持不变 D. 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有_________(填选项序号字母)。
A. 升高温度 B. 缩小容器体积 C. 再充入Cl2气体 D. 使用合适的催化剂
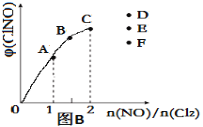
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(B)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是下图中D、E、F三点中的________点。
(2) 在体积为10 L的密闭容器中充入3 mol NO和2 mol Cl2,在不同温度下发生反应2NO(g)+Cl2(g)![]() 2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
2ClNO(g),ClNO的百分含量随时间的变化如图所示。已知T1>T2>T3。
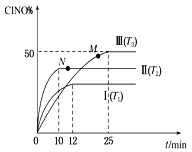
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是__________________。
②实验Ⅲ反应至25 min达到平衡,用NO物质的浓度变化表示的反应速率为__________________。达到平衡时,若实验Ⅲ达到平衡时的热量变化为Q kJ,则该反应的热化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com