
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
![]() 已知
已知![]() 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量,![]() 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。
![]()
![]()
![]()
![]()
请写出制备水煤气的热化学方程式________。
![]() 恒容密闭容器中发生
恒容密闭容器中发生![]() 反应,当通入不同量的
反应,当通入不同量的![]() 和
和![]() 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:
实验组 | 温度
| 起始量
| 平衡量
| 达到平衡所需的时间 | ||
|
|
|
| |||
1 | 650 | 2 |
|
| 2 | 4 |
2 | 650 |
|
|
|
| 5 |
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时![]() ________mol/(Lmin)。
________mol/(Lmin)。
![]() 由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
![]() 若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。
若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。![]() 填编号
填编号![]()
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
![]() 取
取![]() 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
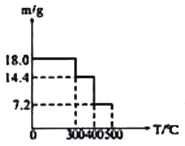
350℃时,固体的成分是________。
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为________。
③取350℃时的上述样品![]() 难溶于水
难溶于水![]() ,置入0.12mol/L、
,置入0.12mol/L、![]() 的酸性
的酸性![]() 溶液中,二者恰好反应,写出该反应的离子方程式________。
溶液中,二者恰好反应,写出该反应的离子方程式________。
【答案】![]()
![]()
![]() 压强增大,反应速率加快,平衡向逆反应方向移动
压强增大,反应速率加快,平衡向逆反应方向移动 ![]()
![]()
![]()
![]()
![]() 5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O
5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O
【解析】
![]()
![]()
![]()
![]() ,
,
![]()
![]()
根据![]() 碳完全燃烧可放出
碳完全燃烧可放出![]() 热量可得:
热量可得:
![]()
![]() ,
,
根据盖斯定律由![]() 可得制备水煤气的热化学方程式。
可得制备水煤气的热化学方程式。
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时 。
。
![]() 实验组1中,H2O的转化率为
实验组1中,H2O的转化率为![]() ,实验组2中,H2O的转化率为
,实验组2中,H2O的转化率为![]() ,由此可知,水蒸气的浓度大,其转化率反而小,从而得出,增大压强对该可逆反应的影响;
,由此可知,水蒸气的浓度大,其转化率反而小,从而得出,增大压强对该可逆反应的影响;
![]() 由于恒温恒压,因此容器中压强始终不变,a不合题意;
由于恒温恒压,因此容器中压强始终不变,a不合题意;
![]() 键断裂,同时断裂
键断裂,同时断裂![]() 键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
![]() ,不能说明反应是否平衡,c不合题意;
,不能说明反应是否平衡,c不合题意;
![]() ,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
![]() 由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。
由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。
![]() 草酸亚铁晶体
草酸亚铁晶体![]() 的物质的量为
的物质的量为![]() ,
,![]() 时固体质量为
时固体质量为![]() ,减少的质量为
,减少的质量为![]() ,减少的质量为水的质量,全部失去结晶水,此时所得的产物为无水盐;
,减少的质量为水的质量,全部失去结晶水,此时所得的产物为无水盐;
![]() 时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为
时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为![]() ,其中铁元素质量为
,其中铁元素质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ,铁元素和氧元素的物质的量之比为
,铁元素和氧元素的物质的量之比为![]() :
:![]() :
:![]() :1,所以剩余固体化学式为FeO;
:1,所以剩余固体化学式为FeO;
![]() 时剩余固体为
时剩余固体为![]() ,其物质的量为
,其物质的量为![]() ,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为
,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为![]() ,当铁元素被氧化为
,当铁元素被氧化为![]() 价,碳元素被氧化为
价,碳元素被氧化为![]() 价时,电子得失守恒,可得出对应反应的离子方程式。
价时,电子得失守恒,可得出对应反应的离子方程式。
![]()
![]()
![]()
![]() ,
,
![]()
![]()
根据![]() 碳完全燃烧可放出
碳完全燃烧可放出![]() 热量可得:
热量可得:
![]()
![]() ,
,
根据盖斯定律由![]() 可得
可得![]()
![]() ;答案为:
;答案为:![]()
![]() ;
;
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时 ;答案为:0.15;
;答案为:0.15;
![]() 实验组1中,H2O的转化率为
实验组1中,H2O的转化率为![]() ,实验组2中,H2O的转化率为
,实验组2中,H2O的转化率为![]() ,由此可知,水蒸气的浓度大,其转化率反而小,从而得出增大压强对该可逆反应的影响是压强增大,反应速率加快,平衡向逆反应方向移动;答案为:压强增大,反应速率加快,平衡向逆反应方向移动;
,由此可知,水蒸气的浓度大,其转化率反而小,从而得出增大压强对该可逆反应的影响是压强增大,反应速率加快,平衡向逆反应方向移动;答案为:压强增大,反应速率加快,平衡向逆反应方向移动;
![]() 由于恒温恒压,因此容器中压强始终不变,a不合题意;
由于恒温恒压,因此容器中压强始终不变,a不合题意;
![]() 键断裂,同时断裂
键断裂,同时断裂![]() 键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
键,此时说明正逆反应速率相等,反应达到平衡,b符合题意;
![]() ,不能说明反应是否平衡,c不合题意;
,不能说明反应是否平衡,c不合题意;
![]() ,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
,没有指明正逆反应速率,不能说明反应是否平衡,d不合题意;
![]() 由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。答案为:be;
由于保持恒温恒压,且反应后气体分子数增大,所以容器体积不变时反应达到平衡,e符合题意。答案为:be;
![]() 草酸亚铁晶体
草酸亚铁晶体![]() 的物质的量为
的物质的量为![]() ,
,![]() 时固体质量为
时固体质量为![]() ,减少的质量为
,减少的质量为![]() ,减少的质量为水的质量,即剩余固体为
,减少的质量为水的质量,即剩余固体为![]() ;答案为:FeC2O4;
;答案为:FeC2O4;
![]() 时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为
时样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,说明有二氧化碳生成;也能使灼热的CuO出现红色,说明有CO生成,剩余固体质量为![]() ,其中铁元素质量为
,其中铁元素质量为![]() ,氧元素的质量为
,氧元素的质量为![]() ,铁元素和氧元素的物质的量之比为
,铁元素和氧元素的物质的量之比为![]() :
:![]() :
:![]() :1,所以剩余固体化学式为FeO,对应反应的方程式为:
:1,所以剩余固体化学式为FeO,对应反应的方程式为:![]()
![]()
![]() ;答案为:
;答案为:![]()
![]()
![]() ;
;
![]() 时剩余固体为
时剩余固体为![]() ,其物质的量为
,其物质的量为![]() ,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为
,根据高锰酸钾的用量可知反应过程中转移电子的物质的量为![]() ,当铁元素被氧化为
,当铁元素被氧化为![]() 价,碳元素被氧化为
价,碳元素被氧化为![]() 价时,电子得失守恒,因此对应的离子方程式为
价时,电子得失守恒,因此对应的离子方程式为
5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O。答案为:5FeC2O4+24H++3MnO4-=5Fe3++10CO2↑+3Mn2++21H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:
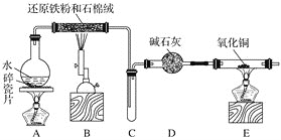
(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_________________________。
(2)装置B中发生反应的化学方程式是____________________________________,该反应中氧化剂是__________,氧化产物是__________________。
(3)D的作用是__________________________________。
(4)E中的实验现象是____________________________。
(5)A、B两个装置中应先点燃________________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种黄绿色或橙黄色的气体,极易溶于水,可用于水的消毒杀菌、水体中Mn2+等重金属清除及烟气的脱硫脱硝。回答下列问题:
(1)将过硫酸钠(Na2S2O8)溶液加入亚氯酸钠(NaClO2)中可制备ClO2,该反应中氧化剂和还原剂的物质的量之比为_____。
(2)将ClO2通入MnSO4溶液,溶液中可检测到Cl-同时有黑色沉淀生成。该反应的离子方程式为__________。
(3)为研究ClO2脱硝的适宜条件,在1L200 mgL-1 ClO2溶液中加NaOH溶液调节pH,通入NO气体并测定NO的去除率,脱硝后N元素以NO3-形式存在,其关系如下图所示:
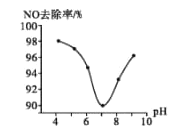
①实验中使用的ClO2溶液的物质的量浓度为______(保留三位有效数字);要使NO的去除率更高,应控制的条件是_________。
②当溶液pH>7时,NO的去除率增大的原因是ClO2与NaOH溶液反应可生成更强的吸收剂NaClO2,写出碱性条件下NaClO2脱除NO反应的离子方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
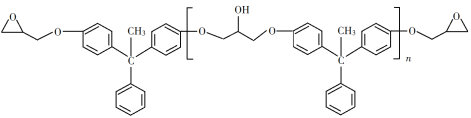
【题目】环氧树脂因其具有良好的机械性能、绝缘性能以及与各种材料的粘结性能,已广泛应用于涂料和胶黏剂等领域。下面是制备一种新型环氧树脂G的合成路线:
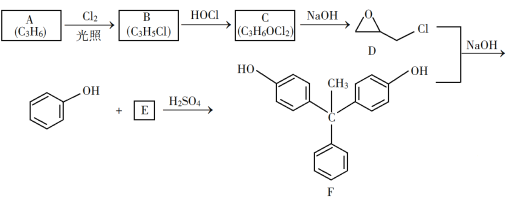
已知以下信息:
①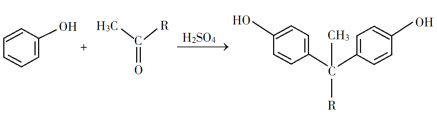 +H2O
+H2O
②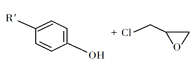 +NaOH
+NaOH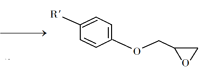 +NaCl+H2O
+NaCl+H2O
③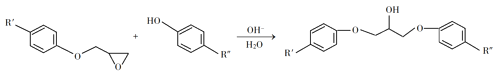
回答下列问题:
(1)A是一种烯烃,化学名称为_____,C中官能团的名称为_____、____。
(2)由C生成D反应方程式为_______。
(3)由B生成C的反应类型为_______。
(4)E的结构简式为_______。
(5)E的二氯代物有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式________、_______。
①能发生银镜反应;②核磁共振氢谱有三组峰,且峰面积比为3∶2∶1。
(6)假设化合物D、F和NaOH恰好完全反应生成1 mol单一聚合度的G,若生成的NaCl和H2O的总质量为765g,则G的n值理论上应等于_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的a、b、c、d四种主族元素,其中a和d同族,a-的电子层结构与氦相同,b和c的次外层有8个电子,b2-、c-和d+的电子层结构相同。下列错误的是( )
A.元素的非金属性次序为c>b>a
B.b2-的还原性弱于c-的还原性
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,用相应的化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中用序号标出的10种元素中,化学性质最不活泼的元素的原子结构示意图是___。
(2)③的单质的电子式为___,结构式为___。
(3)④、⑥、⑧的原子半径由小到大的顺序为___(用元素符号作答)。
(4)金属性最强的是___,非金属性最强的是___,②、③、⑨的最高价氧化物的水化物的酸性由弱到强的顺序是___(用化学式作答)。
(5)由表中两种元素的原子按1:1组成的共价化合物M,M为常见液态化合物,其稀液易被催化分解,请写出M的电子式___,M的结构式___。
(6)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为以正四面体向空间伸展,请写出N及其两种同素异形体的名称___、___、___。
(7)写出⑦元素的最高价氧化物对应水化物分别与元素⑥、⑧的最高价氧化物对应水化物的水溶液反应的离子方程式___、___。
(8)⑥与⑦金属性较强的是___(填元素符号),下列表述中能证明这一事实的是___。
a.⑥的单质和⑦的单质熔沸点不同
b.⑥的最高价氧化物水化物的碱性比⑦的最高价氧化物水化物的碱性强
c.⑦最外层的电子数比⑥多
d.⑦的单质与稀盐酸反应比⑥的缓和一些
(9)①和④形成的气态氢化物与①和⑧形成的气态氢化物相比较,___稳定性强;___沸点高(填化学式),理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200 ℃,将1 mol H2(g)和2 mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH=-c kJ/mol
2HI(g) ΔH=-c kJ/mol
(1)反应刚开始时,由于c(H2)=______ mol/L,c(I2)=______mol/L,而c(HI)=_____,所以化学反应速率 _______最大,而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)_____,c(I2)_____,而c(HI)________,从而化学反应速率v(正)______,而v(逆)_____。(以上填“增大”“减小”或“不变”)
(3)当反应进行到v(正)与v(逆)_______时,此可逆反应就达到了平衡。若保持外界条件不变时,反应混合物的总物质的量为_______mol。此时放出的热量Q_______(填“>”“<”或“=”)c kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
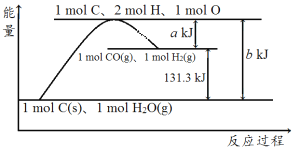
A.反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.amol C和amol H2O(l)反应生成amol CO和a mol H2吸收的热量一定为131.3a kJ
D.1mol C、2mol H、1mol O转变成1mol CO(g)和1mol H2(g)放出的热量为a kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com