
【题目】原子序数依次增大的a、b、c、d四种主族元素,其中a和d同族,a-的电子层结构与氦相同,b和c的次外层有8个电子,b2-、c-和d+的电子层结构相同。下列错误的是( )
A.元素的非金属性次序为c>b>a
B.b2-的还原性弱于c-的还原性
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
科目:高中化学 来源: 题型:
【题目】实验室用50mL0.50mol·L-1盐酸、50mL0.50mol·L-1NaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
实验次数 | 起始温度 | 终止温度 | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |

(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_______
(2)根据上表中所测数据进行计算,则该实验测得的中和热△H=__________(盐酸和NaOH溶液的密度按1gcm-3计算,反应后混合溶液的比热容C按4.18J(g℃)-1计算,结果保留小数点后一位)。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,则实验中测得的“中和热”为△H1,则△H1与△H的关系为△H1________△H(填“大于”、“小于”、“等于”)。如改用60mL0.5mol·L-1的盐酸与50mL 0.55mol·L-1的NaOH 溶液进行反应,与上述实验相比,所放出的热量_______(填“相等”或“不相等”),所求中和热___(填“相等”或“不相等”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是___(填字母序号)。
A 测量盐酸的温度后,温度计没有用水冲洗干净
B 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C 做本实验的当天室温较高
D 将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E 在量取盐酸时仰视计数
F 大烧杯的盖板中间小孔太大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨治理,处理SO2尾气方法较多:
(1)还原法
反应原理:恒温恒容时2C(s)+2SO2(g)S2(g)+2CO2(g)。一定温度下,反应进行到不同时刻测得各物质的浓度部分图像如图:
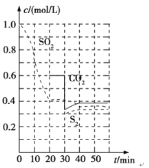
①0~20 min内反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③该反应的平衡常数K=________。
(2)循环利用法
相关反应为①Na2SO3+SO2+H2O=2NaHSO3,②2NaHSO3![]() Na2SO3+SO2↑+H2O。下列说法正确的是________。
Na2SO3+SO2↑+H2O。下列说法正确的是________。
A.反应①进行时,溶液中c(SO32-)/c(HSO![]() )减小,反应②进行时,溶液中c(SO32-)/c(HSO3-)增大
)减小,反应②进行时,溶液中c(SO32-)/c(HSO3-)增大
B.反应①与反应②Kw均为10-14
C.循环利用的物质是Na2SO3溶液,尾气中的氧气对循环利用的次数有影响
D.反应①进行时,2c(SO32-)+c(HSO3-)+c(OH-)之和不变
(3)电解法
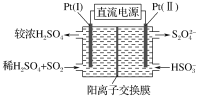
①如图所示,Pt(Ⅰ)电极的反应式为________________;
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________ mol离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.60 g纯铁粉加入适量稀硫酸中,固体完全溶解。加热条件下向反应液中先加入1.7 g NaNO3固体(已知NO3-在酸性条件下具有强氧化性),再通入448 mL Cl2(标准状况下,假设Cl2不逸出),产物中铁元素全部以Fe3+存在。(要求简要写出计算过程)
(1)被氯气氧化的Fe2+物质的量为________。
(2)NaNO3对应的还原产物中氮元素的化合价是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红色固体X由两种元素组成,为探究其组成和性质,设计了如下实验:

请回答:
(1)气体Y的一种同素异形体的分子式是______,红褐色沉淀的化学式______。
(2)X在隔绝空气条件下受高温分解为Y和Z的化学方程式____________。
(3)取黄色溶液W滴加在淀粉KI试纸上,试纸变蓝色,用离子方程式表示试纸变蓝的原因____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
![]() 已知
已知![]() 碳完全燃烧可放出3148kJ热量,
碳完全燃烧可放出3148kJ热量,![]() 液态水汽化时要吸收44kJ热量。
液态水汽化时要吸收44kJ热量。
![]()
![]()
![]()
![]()
请写出制备水煤气的热化学方程式________。
![]() 恒容密闭容器中发生
恒容密闭容器中发生![]() 反应,当通入不同量的
反应,当通入不同量的![]() 和
和![]() 充分反应后得到如下实验数据:
充分反应后得到如下实验数据:
实验组 | 温度
| 起始量
| 平衡量
| 达到平衡所需的时间 | ||
|
|
|
| |||
1 | 650 | 2 |
|
| 2 | 4 |
2 | 650 |
|
|
|
| 5 |
![]() 由实验组1数据可知,达到平衡时
由实验组1数据可知,达到平衡时![]() ________mol/(Lmin)。
________mol/(Lmin)。
![]() 由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
由实验组1和2数据分析可知,增大压强对该可逆反应的影响是________。
![]() 若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。
若在一定温度、容积可变的密闭容器中发生上述反应,下列说法中可判断该反应达到平衡状态的是________。![]() 填编号
填编号![]()
a.容器中压强不变 b.1molH-H键断裂,同时断裂2molO-H键
c.c(H2O)=c(CO) d.v(H2O)=v(H2) e..容器体积不变
![]() 取
取![]() 草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
草酸亚铁晶体(FeC2O4)样品在惰性气体保护气下加热,测得加热过程中样品质量随温度变化的曲线如图所示:
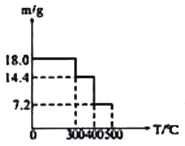
350℃时,固体的成分是________。
②400℃时,样品继续分解得到一种混合气体,该混合气体能使澄清的石灰水变浑浊,也能使灼热的CuO出现红色,则400℃时样品发生反应的化学方程式为________。
③取350℃时的上述样品![]() 难溶于水
难溶于水![]() ,置入0.12mol/L、
,置入0.12mol/L、![]() 的酸性
的酸性![]() 溶液中,二者恰好反应,写出该反应的离子方程式________。
溶液中,二者恰好反应,写出该反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯容易发生聚合生成二聚体,该反应为:![]() 。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )
。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是( )

A.T1>T2
B.a点的正反应速率小于b点的逆反应速率
C.a点的反应速率小于c点的反应速率
D.反应开始至b点时,双环戊二烯平均速率约为:0.45molL-1h-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、M、N四种有机物的有关信息如下表所示:
A | B | M | N |
比例模型为; | 球棍模型为: | 键线式结构为: | ①能与钠反应,但不能与NaOH溶液反应;②能与M反应生成相对分子质量为100的酯 |
请回答:
(1)A在一定条件下可合成包装塑料,反应的化学方程式为____________。
(2)在Ni作催化剂的条件下,B与氢气加热时反应的化学方程式为______________。
(3)M的分子式为__________,M与N反应的化学方程式为_______________。
(4)满足下列条件的M的同分异构体的结构简式为______________。
I:链状 ii:只含一种官能团 iii:能与新制氢氧化铜在加热条件下生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,有错误的是( )
A.Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应
B.在相同温度下,NaHCO3的溶解度比Na2CO3小
C.Na2CO3很稳定,而NaHCO3受热时容易分解
D.将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com