
【题目】 对此聚合物分析正确的是( )
对此聚合物分析正确的是( )
A. 其单体是CH2=CH2和HCOOC2H5
B. 它是缩聚反应产物
C. 其单体是CH2=CH-COOC2H5
D. 其链节是CH3CH2-COOC2H5
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 稳定性:HCl<HBr
B. 氯化钠和冰熔化时,化学键都被破坏
C. H2O2是既含极性键又含非极性键的共价化合物
D. NaOH、NH4Cl、H2SO4在水中均能电离出离子,它们都是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 钠与水反应:Na+2H2O═Na++2OH﹣+H2↑
B. 电解饱和食盐水获取烧碱和氯气:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
C. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH﹣+H++SO42﹣═BaSO4↓+H2O
D. 碳酸钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Mg2+、NH4+、Al3+、Fe3+、CO32—、SO42—、NO3—中的几种。若加入锌粒,产生无色无味的气体;若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是

A. 溶液中的阳离子有H+、Mg2+、NH4+、Al3+
B. 溶液中n(Al3+)=0.1 mol
C. 溶液中一定不含CO32—,可能含有SO42—和NO3—
D. n(H+)∶n(Al3+)∶n(Mg2+)=2∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列有机化合物转化的最佳方法是 ( )
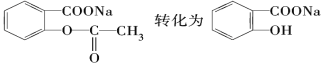
A. 与足量NaOH溶液共热后再通入足量稀硫酸
B. 与足量稀硫酸共热后再加入足量NaOH溶液
C. 与足量稀硫酸共热后再加入足量Na2CO3溶液
D. 与足量NaOH溶液共热后再通入足量CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物是人类抵御疾病的重要武器之一。下列有关药物的说法不正确的是( )
A.“胃得乐”(主要成分为碳酸镁)是一种抗酸药
B.“阿司匹林”是一种重要的抗生素
C.青霉素能抑制细菌细胞壁的生长,致使细菌因细胞破裂而死亡
D.鸦片、吗啡、海洛因等这些物质属于毒品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。在光照条件下,氯气和氢气反应过程如下:
![]()
(1)写出氯元素的原子结构示意图________反应②中形成的化合物的电子式为_________;反应③中被破 坏的化学键属于________键。
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是________________。
(3)与氯元素同周期且金属性最强的元素在周期表中的位置为________________。
(4)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是________________。
a.卤化银的颜色按 AgCl、AgBr、AgI 的顺序依次加深
b.卤化氢的键长按 H—F、H—C1、H—Br、H—I 的顺序依次减小
c.卤化氢的还原性按 HF、HCl、HBr、HI 的顺序依次增强
d.卤素单质与氢气化合按 F2、C12、Br2、I2 的顺序由难变易
(5)卤素单质的键能大小如图。由图推断:

①非金属性强的卤素,其单质分子的化学键_____ 断裂(填“容易”或“不容易”或“不一定容易”)。
②卤素单质键能大小与键长的关系为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硝石又名智利硝石,主要成分为NaNO3。据最新勘探预测表明,我国吐鲁番盆地钠硝石资源量约2.2亿吨,超过了原世界排名第一的智利。一种以钠硝石为原料制备KNO3的流程如下图所示(矿石中其他物质均忽略):

相关化合物溶解度随温度变化曲线如下图所示:

回答下列问题:
(1) NaNO3是________________(填“电解质”或“非电解质”)。
(2) 一定温度下,NaNO3可分解生成Na2O、NO和O2,该反应的化学方程式为__________________。
(3) 为提高钠硝石的溶浸速率,可对矿石进行何种预处理________________(答出一种即可)。
(4) 为减少KNO3的损失,步骤a的操作应为:________________________________;
步骤b中控制温度可为下列选项中的________。
A.10℃ B.40℃ C.60℃ D.90℃
(5) 如何验证洗涤后的KNO3中没有Cl-:_______________________________________。
(6) 若100吨钠硝石可生产60.6吨KNO3,则KNO3的产率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com