
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是___。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
A.用湿润的碘化钾淀粉试纸检验白雾,无变化;
B.用硝酸酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验A目的是___。
②由实验A、B不能判断白雾中含有HC1,理由是___。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是___。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是__。
②用离子方程式解释现象iii中黄绿色褪去的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
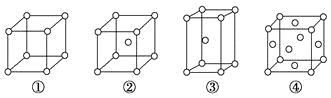
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,反应方程式为:4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A.0~2 min的反应速率小于4~6 min的反应速率
B.2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C.增大压强可以提高HCl转化率
D.平衡常数K(200℃)<K(400℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A. X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B. 气体F经催化氧化可直接生成气体D
C. 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D. X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用![]() 和
和![]() 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ:![]() H1平衡常数为K1
H1平衡常数为K1
反应Ⅱ:![]() H2平衡常数为K2
H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高
H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高![]() 的转化率可采取的措施有________(写出任意两条)。
的转化率可采取的措施有________(写出任意两条)。
(2)一定条件下,在密闭容器中充入![]() 和
和![]() 进行如下反应:
进行如下反应:![]()
![]() 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时![]() 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
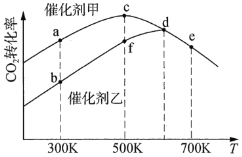
①该可逆反应的反应热H________0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________(填“大”或“小”)。
③![]() 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
④图中达到平衡的点是________。
(3)工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
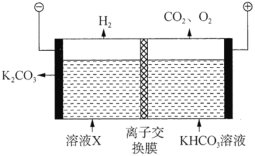
①在阳极区发生的反应有:________和![]() 。
。
②简述![]() 在阴极区再生的原理:________。
在阴极区再生的原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S-诱抗素Y(手性碳原子是指连接有四个不同的原子或原子团的碳原子)。下列法正确的是( )。


A. X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐
B. Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
C. 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH。
D. X结构中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等物质的量的短周期金属单质A和B中,分别加入足量的酸,在A中加盐酸,在B中加稀硫酸。反应完全后,生成的氢气体积分别为VA和VB。,而且VA≠VB。若要确定反应生成物中A和B的化合价,你还可以要求下列选项中任何一个数据,它们是( )
A.VA︰VB的值B.VA或者VB的值
C.所耗两种酸的物质的量之比D.两种酸的摩尔浓度之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G 是合成抗新冠病毒药物的中间体,合成路线如图所示:
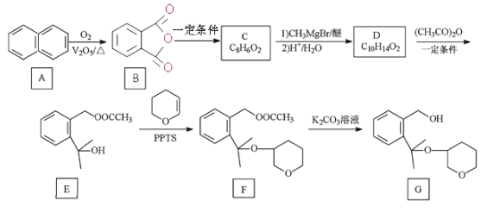
已知:R1COOR2![]()
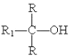 +R2-OH(R、R1、R2分别为烃基)
+R2-OH(R、R1、R2分别为烃基)
回答下列问题:
(1)G 中官能团的名称为____。
(2)C 的结构简式为____。
(3)写出 D 到 E 的方程式____,该反应类型为____。
(4)标 出 F 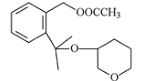 中的手性碳原子___。
中的手性碳原子___。
(5)H 与 G互为同分异构体,写出符合以下条件的一种结构简式____
①能发生水解反应;②核磁共振氢谱峰面积之比为 2:2:9:9
(6)已知RX![]() RMgX (X 表示卤素 原子) ,以苯甲醇 为原料制备
RMgX (X 表示卤素 原子) ,以苯甲醇 为原料制备 ,画出合成路线图___(无机试剂及有机溶剂任选)。
,画出合成路线图___(无机试剂及有机溶剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com