
【题目】工业上可利用![]() 和
和![]() 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ:![]() H1平衡常数为K1
H1平衡常数为K1
反应Ⅱ:![]() H2平衡常数为K2
H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高
H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高![]() 的转化率可采取的措施有________(写出任意两条)。
的转化率可采取的措施有________(写出任意两条)。
(2)一定条件下,在密闭容器中充入![]() 和
和![]() 进行如下反应:
进行如下反应:![]()
![]() 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时![]() 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
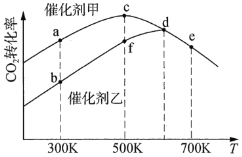
①该可逆反应的反应热H________0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________(填“大”或“小”)。
③![]() 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
④图中达到平衡的点是________。
(3)工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
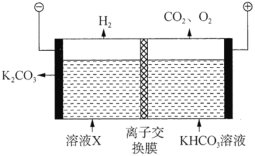
①在阳极区发生的反应有:________和![]() 。
。
②简述![]() 在阴极区再生的原理:________。
在阴极区再生的原理:________。
【答案】![]() 吸热 升高温度、提高氢气的浓度、吸收CO、液化水蒸气 < 小 相等
吸热 升高温度、提高氢气的浓度、吸收CO、液化水蒸气 < 小 相等 ![]()
![]() 阴极区的水电解生成氢气和氢氧根离子,
阴极区的水电解生成氢气和氢氧根离子,![]() 与
与![]() 反应生成
反应生成![]()
【解析】
根据盖斯定律计算K值的大小,判断反应吸热还是放热,根据化学反应速率的影响因素判断。由图象可知随着温度的升高,转化率先增大后减小,则正反应为放热反应,图中a、b、f没有达到平衡状态,催化剂甲的催化效率较高,c、d、e为平衡点;阳极区为物质失去电子,发生氧化反应,根据装置图分析,溶液为碱性,则阳极OH-放电,失去电子,生成O2,据此写出电极反应式;根据溶液中存在的HCO3-的电离平衡和电极反应式简述原理,以此解答该题。
(1)由图可知反应①的K1随温度升高而增大,正反应为吸热反应,△H>0,反应②的K2随温度升高而减小,说明正反应为放热反应,△H<0,
已知:①Fe(s)+CO2(g)FeO(s)+CO(g)△H1>0
②Fe(s)+H2O(g)FeO(s)+H2(g)△H2<0
由盖斯定律①②得,③![]() ,K1=
,K1=![]() ,K2=
,K2=![]() ,K3=
,K3=![]() ×
×![]() =
=![]() ;△H=△H1-△H2>0,,说明是个吸热反应,为提高CO2的转化率可采用措施有升高温度,提高H2浓度(或吸收CO,液化水蒸气)等;
;△H=△H1-△H2>0,,说明是个吸热反应,为提高CO2的转化率可采用措施有升高温度,提高H2浓度(或吸收CO,液化水蒸气)等;
(2)①转化率先增大后减小,说明升高到一定温度时,平衡逆向移动,则正反应为放热反应,该可逆反应的反应热H<0;
②催化剂甲先达到平衡,说明速率较大,则活化能较低,催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能小;
③温度都是![]() ,平衡常数相同,达到平衡状态时,不同催化剂存在的条件下,速率不同,但转化率相同,反应在催化剂甲作用下的转化率和在催化剂乙作用下的转化率相等;
,平衡常数相同,达到平衡状态时,不同催化剂存在的条件下,速率不同,但转化率相同,反应在催化剂甲作用下的转化率和在催化剂乙作用下的转化率相等;
④升高温度后平衡逆向移动,可说明c、d、e三点反应已经达到平衡;图中达到平衡的点是c、d、e;
(3)①阳极区为物质失去电子,发生氧化反应,根据装置图分析,溶液为碱性,则阳极OH-放电,失去电子,生成O2,则阳极区发生的反应有:4OH--4e-=2H2O+O2↑;
②阴极区的水电解生成氢气和氢氧根离子,溶液中存在的HCO3-的电离平衡,在阴极H+优先放电,使得c(H+)减少平衡右移,CO32-再生或者阴极H+放电,使c(OH-)增大,产生的OH-与HCO3-反应生成CO32-。


科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工厂排放的尾气中,含少量的二氧化硫。如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量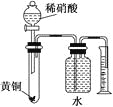
D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+要使溶液中
CH3COO-+H+要使溶液中![]() 值增大,可以采取的措施是( )
值增大,可以采取的措施是( )
A.加少量烧碱溶液B.降低温度
C.加少量冰醋酸D.加水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
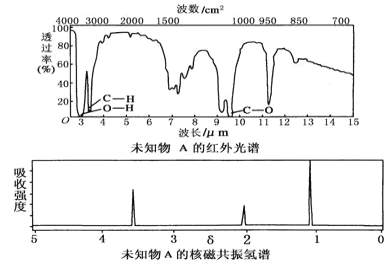
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2= CH2
CH2= CH2![]() CH2=CH2+Br2
CH2=CH2+Br2![]() Br2CH2CH2Br
Br2CH2CH2Br
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”、“下”);
(4)若产物中有少量副产物乙醚.可用_____________的方法除去。
(5)下列关于装置的说法正确的是___________________________;
a.图中仪器a的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)写出第一步的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.标准状况下,气体摩尔体积约为22.4 L/mol
B.非标准状况下,1 mol任何气体都不可能为22.4 L
C.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D.标准状况下,1 mol H2O的体积小于22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1个某种氯原子的质量是a g,1个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12a/b ②m g该氯原子的物质的量为m/(aNA) mol ③该氯原子的摩尔质量是aNA g ④a g该氯原子所含的电子数为17 mol
A.①②B.①③C.②③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com