
【题目】下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量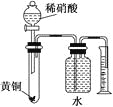
D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去
科目:高中化学 来源: 题型:
【题目】常温下,下列有关电解质溶液的说法错误的是
A.相同浓度的 HCOONa和NaF两溶液,前者的pH较大,则 ![]()
B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7,则溶液中![]()
C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则![]()
D.在![]() 溶液中,
溶液中,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟磷灰石是常见的钙氟磷酸盐矿物,其化学式为Ca5(PO4)3F,由氟磷灰石制取黄磷(P4)的化学式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),请回答下列问题:
(1)基态Ca原子电子所占据最高能级的电子云轮廓图为________,基态P原子的价电子轨道表达式为________。
(2)由氟磷灰石制取黄磷(P4)产物中属于极性分子的化合物是________,与其互为等电子体的分子为________。
(3)黄磷(P4)晶体的空间结构如图甲所示,P的杂化轨道类型为________,磷的一种硫化物P4S3的空间结构如图乙所示,每个S原子中含有孤电子对的数目为________。


(4)SiO2的沸点________(填“大于”或“小于”)CO2的沸点,其原因为________。
(5)Ca与Ti、O元素形成的化合物的晶胞结构如图所示,则该晶体的化学式为________,若晶胞密度为ρgcm-3,阿伏加德罗常数的值为NA,则该晶胞中两个距离最近的O原子之间的距离为________pm(用含ρ、NA的表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,反应方程式为:4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A.0~2 min的反应速率小于4~6 min的反应速率
B.2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C.增大压强可以提高HCl转化率
D.平衡常数K(200℃)<K(400℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验处理,结果得到酸性溶液,而几乎无气体剩余,则气体甲的组成可能为( )
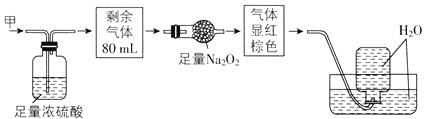
A.NO2、NH3、N2B.NH3、NO、CO2
C.NH3、NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用![]() 和
和![]() 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ:![]() H1平衡常数为K1
H1平衡常数为K1
反应Ⅱ:![]() H2平衡常数为K2
H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高
H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高![]() 的转化率可采取的措施有________(写出任意两条)。
的转化率可采取的措施有________(写出任意两条)。
(2)一定条件下,在密闭容器中充入![]() 和
和![]() 进行如下反应:
进行如下反应:![]()
![]() 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时![]() 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
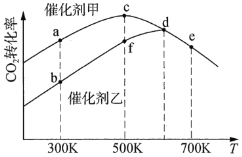
①该可逆反应的反应热H________0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________(填“大”或“小”)。
③![]() 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
④图中达到平衡的点是________。
(3)工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
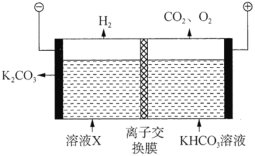
①在阳极区发生的反应有:________和![]() 。
。
②简述![]() 在阴极区再生的原理:________。
在阴极区再生的原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(HCO3-)都减少而c(CO32-)增大,其方法是
A.通入二氧化碳气体B.加入适量氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质为__。
(2)浓硫酸与铜共热,化学方程式为__,浓硫酸表现的性质是__。
(3)浓硫酸与红热木炭反应,化学方程式为__,浓硫酸表现的性质是__。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为__。
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com