
【题目】欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(HCO3-)都减少而c(CO32-)增大,其方法是
A.通入二氧化碳气体B.加入适量氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
【答案】B
【解析】
A.CO2+H2O![]() H2CO3,抑制碳酸氢钠的水解,溶液的碱性减小,氢离子和碳酸氢根离子浓度都增大,故A错误;
H2CO3,抑制碳酸氢钠的水解,溶液的碱性减小,氢离子和碳酸氢根离子浓度都增大,故A错误;
B.NaHCO3+NaOH=Na2CO3+H2O,所以加入氢氧化钠固体后,碳酸氢根离子浓度减小,碳酸根离子浓度增大,氢离子浓度减小,故B正确;
C.HCl+NaHCO3=NaCl+H2O+CO2↑,所以通入氯化氢气体后,碳酸氢根离子浓度减小,碳酸根离子浓度减小,碳酸氢钠溶液呈碱性,通入氯化氢后溶液碱性减弱,所以氢离子浓度增大,故C错误;
D.Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,加入饱和石灰水溶液后,碳酸氢根离子转化为碳酸钙沉淀,所以碳酸氢根离子浓度、碳酸根离子浓度都减小,溶液由弱碱性变为强碱性,所以氢离子浓度也减小,故D错误;
故答案选B。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】金属晶体的原子堆积方式常有以下四种,请认真观察模型(见图),回答下列问题:
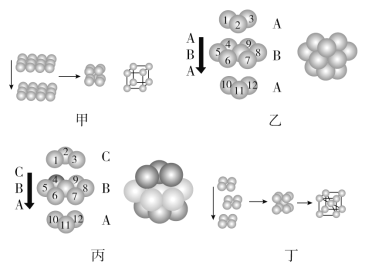
(1)四种堆积模型的堆积名称依次是________、________、________、________。
(2)甲堆积方式中的空间利用率为________,只有金属________采用这种堆积方式。
(3)乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________。
(4)采取丁中堆积方式的金属通常有________(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量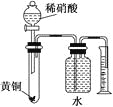
D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
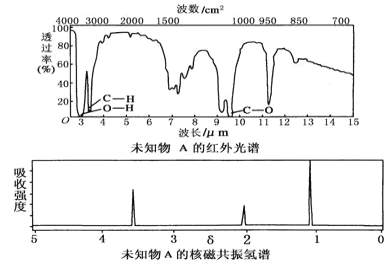
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2= CH2
CH2= CH2![]() CH2=CH2+Br2
CH2=CH2+Br2![]() Br2CH2CH2Br
Br2CH2CH2Br
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”、“下”);
(4)若产物中有少量副产物乙醚.可用_____________的方法除去。
(5)下列关于装置的说法正确的是___________________________;
a.图中仪器a的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)写出第一步的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
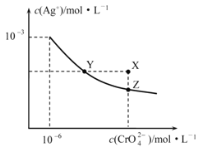
A.在t℃时,Ag2CrO4的Ksp=1×10-9
B.X点有Ag2CrO4沉淀生成
C.通过加热蒸发并恢复到t℃时可以使溶液由Y点变到Z点
D.在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.标准状况下,气体摩尔体积约为22.4 L/mol
B.非标准状况下,1 mol任何气体都不可能为22.4 L
C.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D.标准状况下,1 mol H2O的体积小于22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
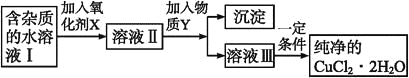
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体之外原子半径最大的元素。下列说法正确的是
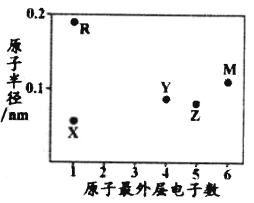
A. M元素在周期表中的位置是第2周期第ⅥA族
B. 元素的最高价氧化物对应水化物的酸性:Z<Y
C. X元素与Y、Z、M三种元素只能各形成一种共价化合物
D. Y、R的单质分别都能与其他物质反应置换出X单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com