
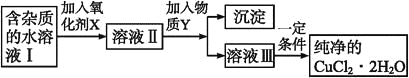
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。
【答案】将Fe2+氧化成Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离 C H2O2+ 2Fe2++ 2H+= 2Fe3++ 2H2O CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3中的一种 不能 3.2-4.7 滤液中加盐酸或在HCl气流中,加热浓缩,冷却结晶,过滤 11.4
【解析】
氯化亚铁和氯化铜的混合液中,加入氧化剂可以将亚铁离子氧化为铁离子,调节pH可以将铁离子沉淀,得到氯化铜的水溶液,然后再酸性环境下蒸发浓缩、冷却结晶,过滤、洗涤、干燥即可得到氯化铜晶体。
(1)根据框图,Fe2+沉淀为氢氧化物时所需pH与Cu2+的沉淀的pH相同,也就是说,Fe2+沉淀的同时,Cu2+也会沉淀,无法将两者分离开,根据题干提供信息可知Fe3+沉淀所需的pH较小,所以应先将Fe2+氧化为Fe3+后再将其除去,加入氧化剂X可把Fe2+氧化为Fe3+,便于生成Fe(OH)3沉淀而与Cu2+分离;
(2)由于没有增加新杂质,所以X为H2O2,反应的离子方程式为H2O2+ 2Fe2++ 2H+= 2Fe3++ 2H2O;
(3)由于不能引入新的杂质,则为了除去Fe3+,需加入物质Y为CuO或Cu(OH)2或CuCO3会Cu2(OH)2CO3等;结合题示,调节pH=3.2~4.7,使Fe3+全部沉淀;
(4)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),所以应在HCl或SOCl2等混合液气氛中采用加热蒸发结晶的方法,以得到CuCl22H2O的晶体;
(5)设需要加入氢氧化钠的物质的量是x mol,则消耗氯化铁是![]() ,所以剩余氯化铁的物质的量是0.1mol-
,所以剩余氯化铁的物质的量是0.1mol-![]() ,则有
,则有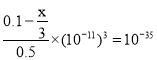 ,解得x=0.285,则氢氧化钠的质量是0.285mol×40g/mol=11.4g。
,解得x=0.285,则氢氧化钠的质量是0.285mol×40g/mol=11.4g。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】氟磷灰石是常见的钙氟磷酸盐矿物,其化学式为Ca5(PO4)3F,由氟磷灰石制取黄磷(P4)的化学式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),请回答下列问题:
(1)基态Ca原子电子所占据最高能级的电子云轮廓图为________,基态P原子的价电子轨道表达式为________。
(2)由氟磷灰石制取黄磷(P4)产物中属于极性分子的化合物是________,与其互为等电子体的分子为________。
(3)黄磷(P4)晶体的空间结构如图甲所示,P的杂化轨道类型为________,磷的一种硫化物P4S3的空间结构如图乙所示,每个S原子中含有孤电子对的数目为________。


(4)SiO2的沸点________(填“大于”或“小于”)CO2的沸点,其原因为________。
(5)Ca与Ti、O元素形成的化合物的晶胞结构如图所示,则该晶体的化学式为________,若晶胞密度为ρgcm-3,阿伏加德罗常数的值为NA,则该晶胞中两个距离最近的O原子之间的距离为________pm(用含ρ、NA的表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(HCO3-)都减少而c(CO32-)增大,其方法是
A.通入二氧化碳气体B.加入适量氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)25℃时,10L水中含H+的个数为________个(设阿伏加德罗常数为NA,下同。),1g水中含H+的个数为________个。
(2)某温度(t℃)时,水的Kw=1×10-12,则该温度________25℃(填“>”“<”或“=”),该温度下,c(H+)=1×10-7mol·L-1的溶液呈________(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________mol·L-1。
II.氯化铁主要用于金属蚀刻、污水处理,具有效果好、价格便宜等优点。请回答下列有关氯化铁的问题:
(1)用FeCl3作净水剂的原理用化学用语解释为________,配制FeCl3溶液时需要加入少量的浓盐酸,其作用为________。
(2)25℃时,Ksp[Fe(OH)3]=4.0×10-38。Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数为______________。
Fe(OH)3+3H+,该反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂充分利用工业废气中的 CO、CO2,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
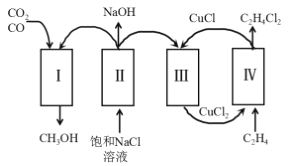
A.为减少副反应的发生,过程Ⅱ中的装置需使用阳离子交换膜
B.在过程Ⅲ中实现了CuCl2 的再生
C.理论上每生成 1molCH3OH,可得到1molC2H4Cl2
D.过程Ⅳ中的反应是C2H4+2CuCl2=C2H4Cl2+2CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有淀粉的 KIO3 酸性溶液滴加 NaHSO3 溶液,溶液先变蓝后褪色。下列说法错误的是
A.溶液先变蓝的原因:2IO![]() +5HSO
+5HSO![]() =I2+5SO
=I2+5SO![]() +H2O+3H+
+H2O+3H+
B.溶液恰好褪色时 n(KIO3):n(NaHSO3)=1:3
C.还原性 I-> HSO![]() >I2
>I2
D.若向含有淀粉的 NaHSO3 溶液中滴加过量 KIO3 酸性溶液,则溶液变蓝不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质为__。
(2)浓硫酸与铜共热,化学方程式为__,浓硫酸表现的性质是__。
(3)浓硫酸与红热木炭反应,化学方程式为__,浓硫酸表现的性质是__。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为__。
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
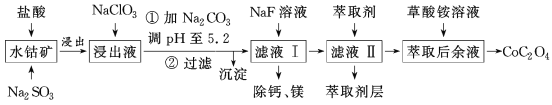
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
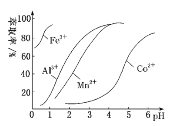
滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com