
ЎѕМвДїЎїI.ЈЁ1Ј©25ЎжК±Ј¬10LЛ®ЦРє¬HЈ«µДёцКэОЄ________ёц(Йи°ў·ьјУµВВЮіЈКэОЄNAЈ¬ПВН¬ЎЈ)Ј¬1gЛ®ЦРє¬HЈ«µДёцКэОЄ________ёцЎЈ
ЈЁ2Ј©ДіОВ¶И(tЎж)К±Ј¬Л®µДKwЈЅ1ЎБ10-12Ј¬ФтёГОВ¶И________25Ўж(МоЎ°>Ў±Ў°<Ў±»тЎ°ЈЅЎ±)Ј¬ёГОВ¶ИПВЈ¬c(HЈ«)ЈЅ1ЎБ10-7molЎ¤LЈ1µДИЬТєіК________(МоЎ°ЛбРФЎ±Ў°јоРФЎ±»тЎ°ЦРРФЎ±)Ј»ИфёГИЬТєЦРЦ»ґжФЪNaOHИЬЦКЈ¬ФтУЙH2OµзАліцАґµДc(OHЈ)ЈЅ________molЎ¤LЈ1ЎЈ
II.ВИ»ЇМъЦчТЄУГУЪЅрКфКґїМЎўОЫЛ®ґ¦АнЈ¬ѕЯУРР§№ыєГЎўјЫёс±гТЛµИУЕµгЎЈЗл»ШґрПВБРУР№ШВИ»ЇМъµДОКМвЈє
ЈЁ1Ј©УГFeCl3Ччѕ»Л®јБµДФАнУГ»ЇС§УГУпЅвКНОЄ________Ј¬ЕдЦЖFeCl3ИЬТєК±РиТЄјУИлЙЩБїµДЕЁСОЛбЈ¬ЖдЧчУГОЄ________ЎЈ
ЈЁ2Ј©25ЎжК±Ј¬Ksp[Fe(OH)3]ЈЅ4.0ЎБ10Ј38ЎЈFe3Ј«·ўЙъЛ®Ѕв·ґУ¦Fe3Ј«Ј«3H2O![]() Fe(OH)3Ј«3HЈ«Ј¬ёГ·ґУ¦µДЖЅєвіЈКэОЄ______________ЎЈ
Fe(OH)3Ј«3HЈ«Ј¬ёГ·ґУ¦µДЖЅєвіЈКэОЄ______________ЎЈ
Ўѕґр°ёЎї10Ј6NA 10Ј10NA > јоРФ 1ЎБ10Ј7 Fe3+Ј«3H2O![]() Fe(OH)3(ЅєМе)Ј«3H+ ·АЦ№Fe3+Л®ЅвК№ИЬТє»лЧЗ 2.5ЎБ10Ј5
Fe(OH)3(ЅєМе)Ј«3H+ ·АЦ№Fe3+Л®ЅвК№ИЬТє»лЧЗ 2.5ЎБ10Ј5
ЎѕЅвОцЎї
I.ЈЁ1Ј©25ЎжК±Ј¬10LЛ®ЦРЗвАлЧУµДОпЦКµДБїКЗ10Ј7molЎ¤LЈ1ЎБ10LЈЅ10Ј6molЈ¬є¬HЈ«µДёцКэОЄ10Ј6NAЈ¬1gЛ®µДМе»эФјКЗ1mLЈ¬ЖдЦРє¬HЈ«µДёцКэОЄ10Ј10NAёцЈ»
ЈЁ2Ј©ДіОВ¶И(tЎж)К±Ј¬Л®µДKwЈЅ1ЎБ10-12Ј¬µзАлОьИИЈ¬ЙэёЯОВ¶ИґЩЅшµзАлЈ¬ФтёГОВ¶ИЈѕ25ЎжЈ¬ёГОВ¶ИПВЈ¬c(HЈ«)ЈЅ1ЎБ10-7molЎ¤LЈ1Јј1ЎБ10-6molЎ¤LЈ1Ј¬ЛщТФИЬТєіКјоРФЈ»ИфёГИЬТєЦРЦ»ґжФЪNaOHИЬЦКЈ¬ТЦЦЖЛ®µДµзАлЈ¬ФтУЙH2OµзАліцАґµДc(OHЈ)ЈЅc(HЈ«)ЈЅ1ЎБ10-7molЎ¤LЈ1Ј»
II.ЈЁ1Ј©МъАлЧУЛ®ЅвЙъіЙЗвСх»ЇМъЅєМеїЙѕ»Л®Ј¬ФтУГFeCl3Ччѕ»Л®јБµДФАнУГ»ЇС§УГУпЅвКНОЄFe3+Ј«3H2O![]() Fe(OH)3(ЅєМе)Ј«3H+Ј¬УЙУЪМъАлЧУЛ®ЅвЙъіЙЗвСх»ЇМъЈ¬ОЄ·АЦ№Fe3+Л®ЅвК№ИЬТє»лЧЗЈ¬ТтґЛЕдЦЖFeCl3ИЬТєК±РиТЄјУИлЙЩБїµДЕЁСОЛбЈ»
Fe(OH)3(ЅєМе)Ј«3H+Ј¬УЙУЪМъАлЧУЛ®ЅвЙъіЙЗвСх»ЇМъЈ¬ОЄ·АЦ№Fe3+Л®ЅвК№ИЬТє»лЧЗЈ¬ТтґЛЕдЦЖFeCl3ИЬТєК±РиТЄјУИлЙЩБїµДЕЁСОЛбЈ»
ЈЁ2Ј©25ЎжК±Ј¬Ksp[Fe(OH)3]ЈЅ4.0ЎБ10Ј38ЎЈFe3Ј«·ўЙъЛ®Ѕв·ґУ¦Fe3Ј«Ј«3H2O![]() Fe(OH)3Ј«3HЈ«Ј¬ёГ·ґУ¦µДЖЅєвіЈКэОЄ
Fe(OH)3Ј«3HЈ«Ј¬ёГ·ґУ¦µДЖЅєвіЈКэОЄ![]() 2.5ЎБ10Ј5ЎЈ
2.5ЎБ10Ј5ЎЈ


 є®јЩМмµШЦШЗміц°жЙзПµБРґр°ё
є®јЩМмµШЦШЗміц°жЙзПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРУР»ъОпГьГыХэИ·µДКЗ
A. 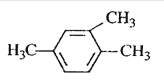 1,3,4-ИэјЧ±Ѕ
1,3,4-ИэјЧ±Ѕ
B. 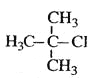 2-јЧ»щ-2-ВИ±ыНй
2-јЧ»щ-2-ВИ±ыНй
C. 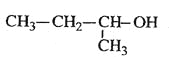 2-јЧ»щ-1-±ыґј
2-јЧ»щ-1-±ыґј
D. 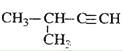 2-јЧ»щ-3-¶ЎИІ
2-јЧ»щ-3-¶ЎИІ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄДіУР»ъОпAµДємНв№вЖЧєНєЛґЕ№ІХсЗвЖЧИзНјЛщКѕЈ¬ПВБРЛµ·ЁЦРґнОуµДКЗЈЁ Ј©
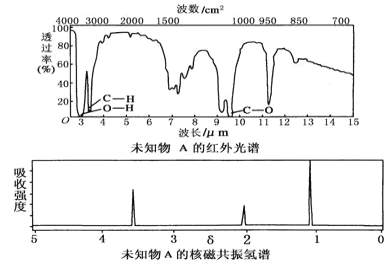
A.УЙємНв№вЖЧїЙЦЄЈ¬ёГУР»ъОпЦРЦБЙЩУРИэЦЦІ»Н¬µД»ЇС§јь
B.УЙєЛґЕ№ІХсЗвЖЧїЙЦЄЈ¬ёГУР»ъОп·ЦЧУЦРУРИэЦЦІ»Н¬»ЇС§»·ѕіµДЗвФЧУ
C.ЅцУЙЖдєЛґЕ№ІХсЗвЖЧОЮ·ЁµГЦЄЖд·ЦЧУЦРµДЗвФЧУЧЬКэ
D.ИфAµД»ЇС§КЅОЄC2H6OЈ¬ФтЖдЅб№№јтКЅОЄCH3ЎЄOЎЄCH3
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїtЎжК±Ag2CrO4ФЪЛ®ЦРµДіБµнИЬЅвЖЅєвЗъПЯИзНјЛщКѕЎЈПВБРЛµ·ЁХэИ·µДКЗ
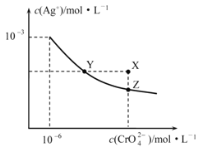
A.ФЪtЎжК±Ј¬Ag2CrO4µДKspЈЅ1ЎБ10Ј9
B.XµгУРAg2CrO4іБµнЙъіЙ
C.НЁ№эјУИИХф·ўІў»ЦёґµЅtЎжК±їЙТФК№ИЬТєУЙYµг±дµЅZµг
D.ФЪ±ҐєНAg2CrO4ИЬТєЦРјУИлK2CrO4Ј¬їЙК№ИЬТєУЙYµг±дµЅXµгЧоЦХ±дµЅZµг
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРЛµ·ЁІ»ХэИ·µДКЗ
A.±кЧјЧґїцПВЈ¬ЖшМеД¦¶ыМе»эФјОЄ22.4 L/mol
B.·З±кЧјЧґїцПВЈ¬1 molИОєОЖшМе¶јІ»їЙДЬОЄ22.4 L
C.±кЧјЧґїцПВЈ¬22.4 LИОєОЖшМеµДОпЦКµДБї¶јФјОЄ1 mol
D.±кЧјЧґїцПВЈ¬1 mol H2OµДМе»эРЎУЪ22.4 L
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДіМЅѕїРФС§П°РЎЧйУыУГЛбјоЦРєНµО¶Ё·ЁІв¶ЁКРКЫ°ЧґЧµДЧЬЛбБї(gЎ¤100mLЈ1)ЎЈУР№ШІЩЧчИзПВЈє
ўс.КµСйІЅЦи
ЈЁ1Ј©УГ________(МоТЗЖчГыіЖ)БїИЎ10.00mLКіУГ°ЧґЧЈ¬ФЪЙХ±ЦРУГЛ®ПЎКНєуЧЄТЖµЅ100mLИЭБїЖїЦР¶ЁИЭЈ¬ТЎФИјґµГґэІв°ЧґЧИЬТєЎЈ
ЈЁ2Ј©УГЛбКЅµО¶Ё№ЬИЎґэІв°ЧґЧИЬТє20.00mLУЪЧ¶РОЖїЦРЈ¬ПтЖдЦРµОјУ2µО________ЧчЦёКѕјБЎЈ
ЈЁ3Ј©¶БИЎКўЧ°0.1000molЎ¤LЈ1NaOHИЬТєµДјоКЅµО¶Ё№ЬµДіхКј¶БКэЎЈИз№ыТєГжО»ЦГИзНјЛщКѕЈ¬ФтґЛК±µД¶БКэОЄ________mLЎЈ
![]()
ЈЁ4Ј©µО¶ЁЎЈµ±__________________________________________________К±Ј¬НЈЦ№µО¶ЁЈ¬ІўјЗВјNaOHИЬТєµДЦХ¶БКэЎЈЦШёґµО¶Ё3ґОЎЈ
ўт.КµСйјЗВј
µО¶ЁґОКэКµСйКэѕЭ(mL) | 1 | 2 | 3 | 4 |
V(СщЖ·) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(ПыєД) | 15.95 | 15.00 | 15.05 | 14.95 |
ўу.КэѕЭґ¦АнУлМЦВЫ
ЈЁ1Ј©ґ¦АнКэѕЭїЙµГЈєc(КРКЫ°ЧґЧ)ЈЅ________molЎ¤LЈ1Ј»КРКЫ°ЧґЧЧЬЛбБїЈЅ________gЎ¤100mLЈ1ЎЈ
ЈЁ2Ј©ФЪ±ѕКµСйµДµО¶Ё№эіМЦРЈ¬ПВБРІЩЧч»бК№КµСйЅб№ыЖ«ґуµДКЗ________МоРґРтєЕ)ЎЈ
aЈ®јоКЅµО¶Ё№ЬФЪµО¶ЁК±ОґУГ±кЧјNaOHИЬТєИуПґ
bЈ®јоКЅµО¶Ё№ЬµДјвЧмФЪµО¶ЁЗ°УРЖшЕЭЈ¬µО¶ЁєуЖшЕЭПыК§
cЈ®Ч¶РОЖїЦРјУИлґэІв°ЧґЧИЬТєєуЈ¬ФЩјУЙЩБїЛ®
dЈ®Ч¶РОЖїФЪµО¶ЁК±ѕзБТТЎ¶ЇЈ¬УРЙЩБїТєМеЅ¦іц
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪОЮ»ъ»ЇєПОпµДМбґїЦРЈ¬іЈАыУГДСИЬµзЅвЦКµДИЬЅвЖЅєвФАніэИҐДіР©ФУЦКАлЧУЎЈПЦУРє¬ВИ»ЇСЗМъФУЦКµДВИ»ЇНѕ§Ме(CuCl2Ў¤2H2O)Ј¬ОЄЦЖИЎґїѕ»µДCuCl2Ў¤2H2OЈ¬КЧПИЅ«ЖдЦЖіЙЛ®ИЬТєЈ¬И»єу°ґИзНјІЅЦиЅшРРМбґїЈє
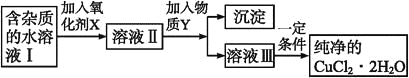
ТСЦЄДіОВ¶ИПВЈєCu2+ЎўFe3+єНFe2+µДЗвСх»ЇОпїЄКјіБµнєНіБµнНкИ«К±µДpHЈ¬јыПВ±нЈє
Fe3+ | Fe2+ | Cu2+ | |
ЗвСх»ЇОпїЄКјіБµнК±µДpH | 1.9 | 7.0 | 4.7 |
ЗвСх»ЇОпНкИ«іБµнК±µДpH | 3.2 | 9.0 | 6.7 |
Зл»ШґрПВБРОКМвЈє
ЈЁ1Ј©јУИлСх»ЇјБXµДДїµДКЗ_______________________ЎЈ
ЈЁ2Ј©ЧоККєПЧчСх»ЇјБXµДКЗ___________ЈЁМо±аєЕЈ¬·сФтІ»ёш·ЦЈ©Ј»РґіцСх»ЇјБXІОУлµДАлЧУ·ґУ¦·ЅіМКЅ_________ЎЈ
AЈ®K2Cr2O7 BЈ®NaClO CЈ®H2O2 DЈ®KMnO4
ЈЁ3Ј©ОЄБЛіэИҐFe3+Ј¬РијУИлОпЦКY_________ЈЁМо»ЇС§КЅЈ©µчЅЪИЬТєµДpHЦµОЄ___________ЎЈ
ЈЁ4Ј©ЧоєуДЬІ»ДЬЦ±ЅУХф·ўЅбѕ§µГµЅCuCl2Ў¤2H2Oѕ§МеЈї________(МоЎ°ДЬЎ±»тЎ°І»ДЬЎ±)Ј»ИфДЬЈ¬І»УГ»ШґрЈ»ИфІ»ДЬЈ¬»ШґрёГИзєОІЩЧчЈї____________________ЎЈ
ЈЁ5Ј©іЈОВПВТСЦЄFe(OH)3µДKsp=1.0ЎБ10-35Ј¬Пт500mL 0.2mol/LµДFeCl3ИЬТєЦРјУИлNaOH№ММе(ИЬТєМе»э±д»ЇєцВФІ»јЖ)єуpH=3.0Ј¬ФтРиТЄјУИлЗвСх»ЇДЖ№ММеµДЦКБїОЄ________gЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТТП©КЗЦШТЄµД»Ї№¤ФБПЈ¬ДїЗ°ЦчТЄНЁ№эКЇУНБ¶»ЇЦЖ±ёЎЈЛжЧЕ»ЇКЇИјБПЧКФґИХТжјхЙЩЈ¬їЖСР№¤ЧчХЯХэФЪМЅЛчєНСР·ўЦЖ±ёТТП©µДРВ·Ѕ·ЁЎЈ
ўсЈ®јЧНйФЪТ»¶ЁМхјюПВНСЗвїЙЙъіЙТТП©Јє2CH4(g)![]() C2H4(g)Ј«2H2(g)ЎчHЈѕ0
C2H4(g)Ј«2H2(g)ЎчHЈѕ0
ЈЁ1Ј©»о»ЇДЬEaХэ____EaДжЈЁМоЎ°ЈѕЎ±ЎўЎ°ЈЅЎ±»тЎ°ЈјЎ±Ј¬ПВН¬Ј©Ј»kХэЎўkДж±нКѕЛЩВКіЈКэЈ¬µ±ЙэёЯОВ¶ИК±Ј¬kХэФцґуµД±¶Кэ____kДжФцґуµД±¶КэЎЈ
ўтЈ®АыУГЙъОпОЮЛ®ТТґјґЯ»ЇНСЛ®ЦЖ±ёТТП©
Цч·ґУ¦ iЈєC2H5OH(g)![]() C2H4(g)Ј«H2O(g)ЎчH1ЈЅ+45.5 kJ/mol
C2H4(g)Ј«H2O(g)ЎчH1ЈЅ+45.5 kJ/mol
ё±·ґУ¦ iiЈє2C2H5OH(g)![]() C2H5OC2H5(g)Ј«H2O(g)ЎчH2ЈЅ©Ѓ19.0 kJ/mol
C2H5OC2H5(g)Ј«H2O(g)ЎчH2ЈЅ©Ѓ19.0 kJ/mol
ё±·ґУ¦ iiiЈєC2H5OC2H5(g)![]() 2C2H4(g)Ј«H2O(g)ЎчH3
2C2H4(g)Ј«H2O(g)ЎчH3
ЈЁ2Ј©ЗуЎчH3ЈЅ____ЎЈ
ЈЁ3Ј©ФЪ 2L єгИЭГЬ±ХИЭЖчЦРідИл2mol C2H5OH(g)єНТ»¶ЁБїµДґЯ»ЇјБЅшРР·ґУ¦Ј¬ЖЅєвМеПµЦРє¬МјЧй·ЦµДОпЦКµДБї·ЦКэЛжОВ¶ИµД±д»ЇИзНјЛщКѕЈє
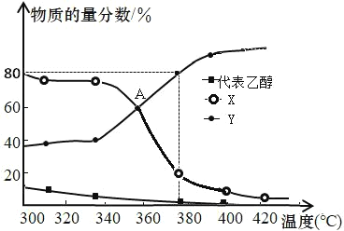
ўЩНјЦР Y ґъ±н____ЈЁМоЎ°C2H4Ў±»тЎ°C2H5OC2H5Ў±Ј©Ј¬ЗлЅвКНФТт____ЎЈ
ўЪЦч·ґУ¦ i ФЪ A µгґпµЅЖЅєвЧґМ¬µД±кЦѕОЄ____ЎЈ
a.ТТП©ЕЁ¶ИІ»ФЩ±д»Ї b.ИЭЖчДЪС№ЗїІ»ЛжК±јд±д»Ї
c.»мєПЖшМеµДГЬ¶ИІ»ЛжК±јд±д»Ї d.ЎчH І»ФЩ±д»Ї
ўЫ380ЎжК±Ј¬јЩЙиТТґјНкИ«·ґУ¦Ј¬Фт·ґУ¦ iii µДЖЅєвіЈКэ KЈЅ____ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї»ЇС§УлЙъ»оЎўЙз»бГЬЗРПа№ШЈ¬ПВБРЛµ·ЁХэИ·µДКЗ (ЎЎЎЎ)
A.НЁРЕ№вАВµДЦчТЄіЙ·ЦКЗѕ§МеSiЈ¬М«СфДЬµзіШµДІДБПЦчТЄКЗSiO2
B.ёЯГМЛбјШИЬТєЎўѕЖѕ«ЎўЛ«СхЛ®¶јДЬЙ±ѕъПы¶ѕЈ¬¶јАыУГБЛЗїСх»ЇРФ
C.Ў°№в»ЇС§СМОнЎ±ЎўЎ°іфСхїХ¶ґЎ±µДРОіЙ¶јУлµЄСх»ЇєПОпУР№Ш
D.ТФЎ°µШ№µУНЎ±ОЄФБПЙъІъµДЙъОпІсУНУлТФЎ°КЇУНЎ±ОЄФБПЙъІъµДІсУН»ЇС§іЙ·ЦПаЛЖ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com