
【题目】化学与生活、社会密切相关,下列说法正确的是 ( )
A.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
B.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
C.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
D.以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
科目:高中化学 来源: 题型:
【题目】I.(1)25℃时,10L水中含H+的个数为________个(设阿伏加德罗常数为NA,下同。),1g水中含H+的个数为________个。
(2)某温度(t℃)时,水的Kw=1×10-12,则该温度________25℃(填“>”“<”或“=”),该温度下,c(H+)=1×10-7mol·L-1的溶液呈________(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________mol·L-1。
II.氯化铁主要用于金属蚀刻、污水处理,具有效果好、价格便宜等优点。请回答下列有关氯化铁的问题:
(1)用FeCl3作净水剂的原理用化学用语解释为________,配制FeCl3溶液时需要加入少量的浓盐酸,其作用为________。
(2)25℃时,Ksp[Fe(OH)3]=4.0×10-38。Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数为______________。
Fe(OH)3+3H+,该反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期主族元素 X、 Y、 Z、 R、 Q, 它们的原子序数逐渐增大; 在周期表中的相对位置如图所示,Z是组成叶绿素的金属元素。下列说法错误的是
![]()
A.工业上都用电解法制Z、R单质
B.X和Y 的单质熔点: X<Y
C.Z、R、Y 的简单离子半径: Y>Z>R
D.Y和Q的最高价氧化物对应水化物酸性:Y>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g)==C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是 ( )

A. 正反应活化能大于逆反应活化能
B. 曲线b表示使用催化剂后的能量变化
C. 由图可知该反应的焓变△H=+91kJ/mol
D. 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
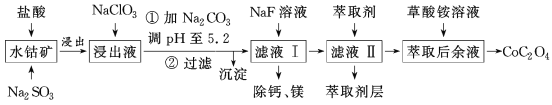
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
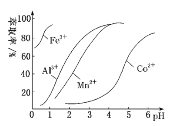
滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述错误的是( )

A.H3BO3在水溶液中发生H3BO3+H2O![]() H++[B(OH4)],可知H3BO3是一元弱酸
H++[B(OH4)],可知H3BO3是一元弱酸
B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子
C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,lmolNH4BF4含有配位键的数目为NA
D.由B2O3可制备晶体硼,晶体硼的熔点2573K,沸点2823K,硬度大,属于共价晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用滴定管量取一定体积的浓氯水置于锥形瓶中,用![]() 溶液以恒定速度来滴定,根据测定结果绘制出
溶液以恒定速度来滴定,根据测定结果绘制出![]() 、
、![]() 等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
等离子的物质的量浓度c与时间t的关系曲线如下。下列说法正确的是( )
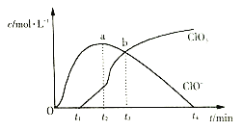
A.![]() 溶液和浓氯水可以使用同种滴定管盛装
溶液和浓氯水可以使用同种滴定管盛装
B.a点溶液中存在如下关系:![]()
C.b点溶液中各离子浓度:![]()
D.![]() ,
,![]() 生成速率越来越快
生成速率越来越快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com