
【题目】有五种短周期主族元素 X、 Y、 Z、 R、 Q, 它们的原子序数逐渐增大; 在周期表中的相对位置如图所示,Z是组成叶绿素的金属元素。下列说法错误的是
![]()
A.工业上都用电解法制Z、R单质
B.X和Y 的单质熔点: X<Y
C.Z、R、Y 的简单离子半径: Y>Z>R
D.Y和Q的最高价氧化物对应水化物酸性:Y>Q
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
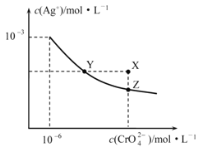
A.在t℃时,Ag2CrO4的Ksp=1×10-9
B.X点有Ag2CrO4沉淀生成
C.通过加热蒸发并恢复到t℃时可以使溶液由Y点变到Z点
D.在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点变到X点最终变到Z点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,目前主要通过石油炼化制备。随着化石燃料资源日益减少,科研工作者正在探索和研发制备乙烯的新方法。
Ⅰ.甲烷在一定条件下脱氢可生成乙烯:2CH4(g)![]() C2H4(g)+2H2(g)△H>0
C2H4(g)+2H2(g)△H>0
(1)活化能Ea正____Ea逆(填“>”、“=”或“<”,下同);k正、k逆表示速率常数,当升高温度时,k正增大的倍数____k逆增大的倍数。
Ⅱ.利用生物无水乙醇催化脱水制备乙烯
主反应 i:C2H5OH(g)![]() C2H4(g)+H2O(g)△H1=+45.5 kJ/mol
C2H4(g)+H2O(g)△H1=+45.5 kJ/mol
副反应 ii:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g)△H2=﹣19.0 kJ/mol
C2H5OC2H5(g)+H2O(g)△H2=﹣19.0 kJ/mol
副反应 iii:C2H5OC2H5(g)![]() 2C2H4(g)+H2O(g)△H3
2C2H4(g)+H2O(g)△H3
(2)求△H3=____。
(3)在 2L 恒容密闭容器中充入2mol C2H5OH(g)和一定量的催化剂进行反应,平衡体系中含碳组分的物质的量分数随温度的变化如图所示:
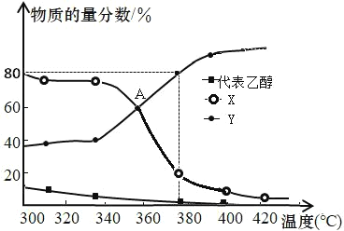
①图中 Y 代表____(填“C2H4”或“C2H5OC2H5”),请解释原因____。
②主反应 i 在 A 点达到平衡状态的标志为____。
a.乙烯浓度不再变化 b.容器内压强不随时间变化
c.混合气体的密度不随时间变化 d.△H 不再变化
③380℃时,假设乙醇完全反应,则反应 iii 的平衡常数 K=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2。
②氯气和碱反应放出热量。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置进行实验。
5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置进行实验。
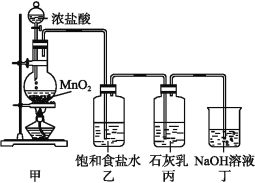
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是________。
②该兴趣小组用100 mL12 mol·L-1盐酸与8.7 g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g。
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,部分氯气未与石灰乳反应而逸出,以及温度升高也是可能原因。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为如图(不考虑氯气和水的反应)。
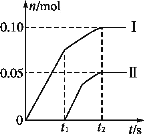
①图中曲线Ⅰ表示_______离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为______mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.35 mol,则产物中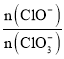 =__。
=__。
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你写出一种改进方法:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体之外原子半径最大的元素。下列说法正确的是
A. M元素在周期表中的位置是第2周期第ⅥA族
B. 元素的最高价氧化物对应水化物的酸性:Z<Y
C. X元素与Y、Z、M三种元素只能各形成一种共价化合物
D. Y、R的单质分别都能与其他物质反应置换出X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
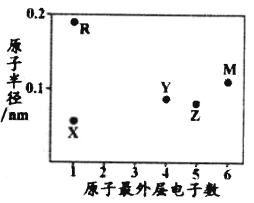
【题目】氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以![]() 、
、![]() 、
、![]() 、
、![]() 的形式存在。
的形式存在。
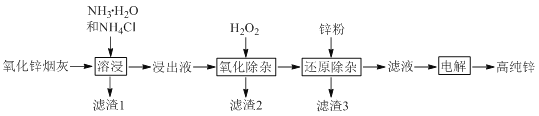
回答下列问题:
![]() 中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
中Zn的化合价为_______,“溶浸”中ZnO发生反应的离子方程式为_______。
![]() 锌浸出率与温度的关系如图所示,分析
锌浸出率与温度的关系如图所示,分析![]() 时锌浸出率最高的原因为_______。
时锌浸出率最高的原因为_______。

![]() “氧化除杂”中,
“氧化除杂”中,![]() 转化为
转化为![]() 胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
胶体吸附聚沉除去,溶液始终接近中性。该反应的离子方程式为_______。
![]() “滤渣3”的主要成分为_______。
“滤渣3”的主要成分为_______。
![]() “电解”时
“电解”时![]() 在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的
在阴极放电的电极反应式为______。阳极区放出一种无色无味的气体,将其通入滴有KSCN的![]() 溶液中,无明显现象,该气体是_______
溶液中,无明显现象,该气体是_______![]() 写化学式
写化学式![]() 。电解后的电解液经补充_______
。电解后的电解液经补充_______![]() 写一种物质的化学式
写一种物质的化学式![]() 后可返回“溶浸”工序继续使用。
后可返回“溶浸”工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会密切相关,下列说法正确的是 ( )
A.通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2
B.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性
C.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
D.以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
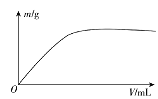
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传统中药“金银花”中抗菌杀毒的有效成分是“绿原酸”。某高中化学创新兴趣小组运用所学知识并参考相关文献,设计了一种“绿原酸”的合成路线如图:
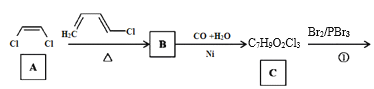
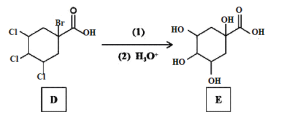
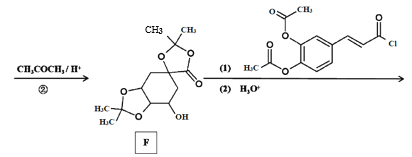
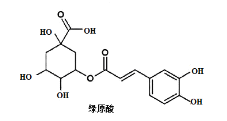
已知:① ;
;
②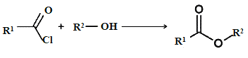 。
。
回答下列问题:
(1)有机物A的名称是___,A→B的反应类型___。
(2)C的结构简式___,有机物F中官能团的名称是___。
(3)若碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。用星号(*)标出E中的手性碳: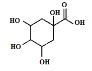 ___。
___。
(4)反应②的目的是__,写出D→E中第(1)步的反应方程式___。
(5)绿原酸在碱性条件下完全水解后,再酸化,得到的芳香族化合物的同分异构体有多种,满足以下条件的有___种(不考虑立体异构,任写一种)。
a.含有苯环
b.1mol该物质能与2molNaHCO3反应
写出核磁共振氢谱显示峰面积之比为3:2:2:1的结构简式为__。
(6)参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线___(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com