
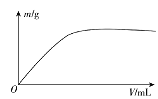
【题目】短周期主族元素X、Y、Z、W,已知X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层;Y广泛作电池材料且单位质量的金属提供电子数目最多;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质:向含W元素的钠盐溶液中通入x的氧化物,观察到沉淀质量(m)与X的氧化物体积(V)关系如图所示。下列说法正确的是( )
A.Y的单质在空气中燃烧生成过氧化物和氮化物
B.W一定位于周期表中第三周期IIIA族
C.X的含氧酸的酸性可能比Z的含氧酸的酸性强
D.Z和W组成的化合物可能是离子化合物
【答案】C
【解析】
X的某种氢化物可使溴的四氯化碳溶液褪色,X原子电子占据2个电子层,X为C元素;Y广泛作电池材料且单位质量的金属提供电子数目最多,Y为Li元素;实验室可用Z的简单氢化物的浓溶液和KMnO4固体在常温下制备Z的单质,Z为Cl元素;向含W元素的钠盐溶液中通入x的氧化物,产生沉淀且不溶解,W为Al或Si元素,据此分析解答。
由上述分析可知:X为C元素;Y为Li元素;Z为Cl元素;W为Al或Si元素。
A、Li在空气中燃烧不能生成过氧化物,故A错误;
B、W为Al或Si元素,不一定位于周期表中第三周期IIIA族,故B错误;
C、X为C元素,其含氧酸可能是碳酸,Z为Cl元素,其含氧酸可能是次氯酸,碳酸的酸性强于次氯酸,故C正确;
D、Z为Cl元素,W为Al或Si元素,Z和W组成的化合物可能为四氯化碳或氯化铝,两者都是共价化合物,故D错误。
答案选C。


科目:高中化学 来源: 题型:
【题目】向含有淀粉的 KIO3 酸性溶液滴加 NaHSO3 溶液,溶液先变蓝后褪色。下列说法错误的是
A.溶液先变蓝的原因:2IO![]() +5HSO
+5HSO![]() =I2+5SO
=I2+5SO![]() +H2O+3H+
+H2O+3H+
B.溶液恰好褪色时 n(KIO3):n(NaHSO3)=1:3
C.还原性 I-> HSO![]() >I2
>I2
D.若向含有淀粉的 NaHSO3 溶液中滴加过量 KIO3 酸性溶液,则溶液变蓝不褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种短周期主族元素 X、 Y、 Z、 R、 Q, 它们的原子序数逐渐增大; 在周期表中的相对位置如图所示,Z是组成叶绿素的金属元素。下列说法错误的是
![]()
A.工业上都用电解法制Z、R单质
B.X和Y 的单质熔点: X<Y
C.Z、R、Y 的简单离子半径: Y>Z>R
D.Y和Q的最高价氧化物对应水化物酸性:Y>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+2B(g)==C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是 ( )

A. 正反应活化能大于逆反应活化能
B. 曲线b表示使用催化剂后的能量变化
C. 由图可知该反应的焓变△H=+91kJ/mol
D. 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图所示。
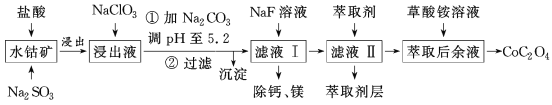
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
金属离子 | Fe3+ | Fe2+ | Co2+ | Al3+ | Mn2+ |
沉淀完全的pH | 2.8 | 8.3 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是___。
(2)写出加入NaClO3后发生反应的离子方程式__,检验离子是否反应完全的试剂是__(写试剂名称)。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。
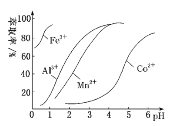
滤液Ⅱ中加入萃取剂的作用是___,使用萃取剂适宜的pH是___(填序号)。
A.接近2.0 B.接近3.0 C.接近5.0
(4)除“钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液中![]() =__。
=__。
(5)工业上用氨水吸收废气中的SO2。已知NH3·H2O的电离常数Kb=1.8×10-5,H2SO3的电离常数Ka1=1.2×10-2,Ka2=1.3×10-8。在通入废气的过程中:当恰好形成正盐时,溶液中离子浓度的大小关系为__,当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如图所示。下列叙述错误的是( )

A.H3BO3在水溶液中发生H3BO3+H2O![]() H++[B(OH4)],可知H3BO3是一元弱酸
H++[B(OH4)],可知H3BO3是一元弱酸
B.六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,立方氮化硼晶胞中含有4个氮原子、4个硼原子
C.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一,lmolNH4BF4含有配位键的数目为NA
D.由B2O3可制备晶体硼,晶体硼的熔点2573K,沸点2823K,硬度大,属于共价晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是一种天然除草剂,其结构如图所示,下列说法正确的是( )
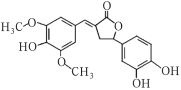
A.Y可以和Na2CO3溶液发生反应
B.Y分子中所有碳原子一定在同一平面内
C.1molY最多能与6molNaOH反应
D.Y与足量的H2发生加成反应的产物含9个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com