
【题目】下列说法不正确的是
A.标准状况下,气体摩尔体积约为22.4 L/mol
B.非标准状况下,1 mol任何气体都不可能为22.4 L
C.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D.标准状况下,1 mol H2O的体积小于22.4 L
科目:高中化学 来源: 题型:
【题目】工业上可利用![]() 和
和![]() 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ:![]() H1平衡常数为K1
H1平衡常数为K1
反应Ⅱ:![]() H2平衡常数为K2
H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高
H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高![]() 的转化率可采取的措施有________(写出任意两条)。
的转化率可采取的措施有________(写出任意两条)。
(2)一定条件下,在密闭容器中充入![]() 和
和![]() 进行如下反应:
进行如下反应:![]()
![]() 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时![]() 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
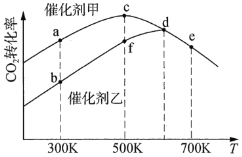
①该可逆反应的反应热H________0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________(填“大”或“小”)。
③![]() 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
④图中达到平衡的点是________。
(3)工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
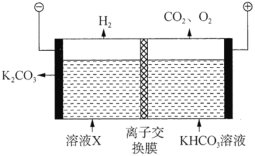
①在阳极区发生的反应有:________和![]() 。
。
②简述![]() 在阴极区再生的原理:________。
在阴极区再生的原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲使0.1mol·L-1的NaHCO3溶液中c(H+)、c(HCO3-)都减少而c(CO32-)增大,其方法是
A.通入二氧化碳气体B.加入适量氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等物质的量的短周期金属单质A和B中,分别加入足量的酸,在A中加盐酸,在B中加稀硫酸。反应完全后,生成的氢气体积分别为VA和VB。,而且VA≠VB。若要确定反应生成物中A和B的化合价,你还可以要求下列选项中任何一个数据,它们是( )
A.VA︰VB的值B.VA或者VB的值
C.所耗两种酸的物质的量之比D.两种酸的摩尔浓度之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)25℃时,10L水中含H+的个数为________个(设阿伏加德罗常数为NA,下同。),1g水中含H+的个数为________个。
(2)某温度(t℃)时,水的Kw=1×10-12,则该温度________25℃(填“>”“<”或“=”),该温度下,c(H+)=1×10-7mol·L-1的溶液呈________(填“酸性”“碱性”或“中性”);若该溶液中只存在NaOH溶质,则由H2O电离出来的c(OH-)=________mol·L-1。
II.氯化铁主要用于金属蚀刻、污水处理,具有效果好、价格便宜等优点。请回答下列有关氯化铁的问题:
(1)用FeCl3作净水剂的原理用化学用语解释为________,配制FeCl3溶液时需要加入少量的浓盐酸,其作用为________。
(2)25℃时,Ksp[Fe(OH)3]=4.0×10-38。Fe3+发生水解反应Fe3++3H2O![]() Fe(OH)3+3H+,该反应的平衡常数为______________。
Fe(OH)3+3H+,该反应的平衡常数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂充分利用工业废气中的 CO、CO2,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
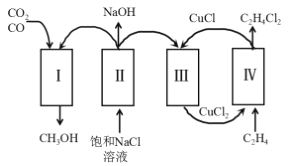
A.为减少副反应的发生,过程Ⅱ中的装置需使用阳离子交换膜
B.在过程Ⅲ中实现了CuCl2 的再生
C.理论上每生成 1molCH3OH,可得到1molC2H4Cl2
D.过程Ⅳ中的反应是C2H4+2CuCl2=C2H4Cl2+2CuCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有:①难挥发性(高沸点);②酸性;③强氧化性;④吸水性;⑤脱水性。下列各项分别表现浓硫酸的什么性质,请将序号填于空白处:
(1)浓硫酸与食盐共热,浓硫酸表现的性质为__。
(2)浓硫酸与铜共热,化学方程式为__,浓硫酸表现的性质是__。
(3)浓硫酸与红热木炭反应,化学方程式为__,浓硫酸表现的性质是__。
(4)可用浓硫酸干燥H2、CO2、HCl等气体,浓硫酸表现的性质为__。
(5)蔗糖中倒入浓硫酸,蔗糖变黑,体积膨胀,且有刺激性气味的气体产生,浓硫酸表现的性质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com