
【题目】某化工厂充分利用工业废气中的 CO、CO2,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
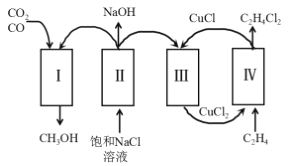
A.为减少副反应的发生,过程Ⅱ中的装置需使用阳离子交换膜
B.在过程Ⅲ中实现了CuCl2 的再生
C.理论上每生成 1molCH3OH,可得到1molC2H4Cl2
D.过程Ⅳ中的反应是C2H4+2CuCl2=C2H4Cl2+2CuCl
【答案】C
【解析】
根据联合生产流程图分析可知,过程Ⅱ中发生反应2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,生成的H2参与过程Ⅰ,与CO2、CO反应生成CH3OH,Cl2参与过程Ⅲ发生反应2CuCl+Cl2=2CuCl2,CuCl2进入过程Ⅳ中发生反应2CuCl2+C2H4=C2H4Cl2+2CuCl,据此分析解答。
2NaOH+Cl2↑+H2↑,生成的H2参与过程Ⅰ,与CO2、CO反应生成CH3OH,Cl2参与过程Ⅲ发生反应2CuCl+Cl2=2CuCl2,CuCl2进入过程Ⅳ中发生反应2CuCl2+C2H4=C2H4Cl2+2CuCl,据此分析解答。
A.根据上述分析可知,过程Ⅱ为电解饱和NaCl溶液的过程,为减少副反应的发生,装置中可使用阳离子交换膜,A选项正确;
B.过程Ⅲ发生的反应主要为过程Ⅳ产生的CuCl与Cl2反应生成CuCl2,CuCl2再进入过程Ⅳ反应,实现了CuCl2的再生,B选项正确;
C.过程Ⅰ为H2与CO2、CO反应生成CH3OH,过程中H元素的化合价由0价升高为+1价,则每生成1molCH3OH转移4mol电子,过程Ⅲ发生反应2CuCl+Cl2=2CuCl2,过程Ⅳ中发生反应2CuCl2+C2H4=C2H4Cl2+2CuCl,每生成1molC2H4Cl2转移2mol电子,结合过程Ⅱ中发生的反应,则理论上每生成1molCH3OH,可得到2molC2H4Cl2,C选项错误;
D.由分析可知,过程Ⅳ中的反应是C2H4+2CuCl2=C2H4Cl2+2CuCl,D选项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】某硫酸工厂排放的尾气中,含少量的二氧化硫。如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2= CH2
CH2= CH2![]() CH2=CH2+Br2
CH2=CH2+Br2![]() Br2CH2CH2Br
Br2CH2CH2Br
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”、“下”);
(4)若产物中有少量副产物乙醚.可用_____________的方法除去。
(5)下列关于装置的说法正确的是___________________________;
a.图中仪器a的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)写出第一步的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.标准状况下,气体摩尔体积约为22.4 L/mol
B.非标准状况下,1 mol任何气体都不可能为22.4 L
C.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D.标准状况下,1 mol H2O的体积小于22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,由一氧化碳和二氧化碳组成的混合气体为6.72 L,质量为12g,此混合物中一氧化碳和二氧化碳物质的量之比是__________,一氧化碳的体积分数是__________,一氧化碳的质量分数是__________,碳原子和氧原子个数比是__________,混合气体的平均相对分子质量是__________,密度是__________g·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
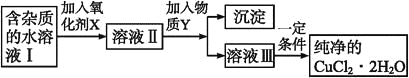
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1个某种氯原子的质量是a g,1个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12a/b ②m g该氯原子的物质的量为m/(aNA) mol ③该氯原子的摩尔质量是aNA g ④a g该氯原子所含的电子数为17 mol
A.①②B.①③C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com