
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
【答案】C
【解析】分析:A. Fe(NO3)2溶液中滴入硫酸,会形成HNO3,因此溶液变为黄色,有可能是HNO3氧化Fe2+; B.溶度积常数大的物质能转化为溶度积小的物质;C. 升高温度,可逆反应向吸热反应方向移动;D. KMnO4与乙二醇(HOCH2CH2OH)发生氧化还原反应生成二氧化碳,且高锰酸钾可氧化乙二酸。
详解:A. Fe(NO3)2溶液中滴入硫酸,会形成HNO3,因此溶液变为黄色,有可能是HNO3氧化Fe2+,结论错误,故A错误;
B.溶度积常数大的物质能转化为溶度积小的物质,根据现象知,Ksp[Cu(OH)2]
<Ksp[Mg(OH)2],结论错误,故B错误;
C. 升高温度,可逆反应向吸热反应方向移动,升高温度气体颜色加深,说明平衡向生成二氧化氮方向移动,所以正反应是放热反应,所以C选项是正确的;
D. KMnO4与乙二醇(HOCH2CH2OH)发生氧化还原反应生成二氧化碳,且高锰酸钾可氧化乙二酸,结论不合理,所以D选项是错误的。
答案选C。


科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是
W(s)+3H2O(g),下列说法不正确的是
A. 增加H2O(g)的量,消耗H2的速率瞬间不变
B. 将容器的体积缩小一半,其反应速率加快
C. 保持体积不变,充入氩气,其反应速率不变
D. 保持压强不变,充入氖气,H2O(g)生成速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
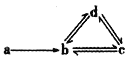
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花中可提取一种简写为HIn的有机物,在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。HIn(aq,红色)![]() H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、 (3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
H++In-(aq,黄色),在浓度为0.02 mol·L-1的下列各溶液(1)HCl、(2)Na2O2、 (3)NaCl(aq)、(4)NaHSO4(aq)、(5)NaHCO3(aq)、(6)氨水中,加入该指示剂,其中能使指示剂显黄色的是
A. (1)(4)(5) B. (2)(6) C. (1)(3)(4) D. (5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
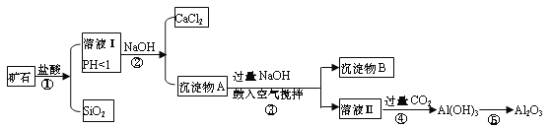
(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中能发生反应,且甲组为取代反应,乙组为加成反应的是( )。
甲 | 乙 | |
A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
B | 油脂水解(催化剂、加热) | 苯与氢气(催化剂、加热) |
C | 淀粉水解制葡萄糖(催化剂) | 乙酸和乙醇的酯化反应(催化剂、加热) |
D | 乙烯与溴的四氯化碳溶液 | 甲烷与氯气(光照) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Na2SO3、Na2S04混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
A. 将样品配制成溶液V1L,取其中25.00 mL用标准KMn04溶液滴定,消耗标准 KMn04 溶液V2 mL
B. 向样品中加足量H202,再加足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为bg
C. 将样品与足量稀盐酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称量其质量为c g
D. 将样品与足量稀盐酸充分反应,生成的气体依次通过盛有饱和NaHS03的洗气瓶、盛有浓H2S04的洗气瓶、盛有碱石灰的干燥管I、盛有碱石灰的干燥管II,测得干燥管I增重dg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。请回答下列问题:
(1)甲组同学取l0mL0.l mol·L-1KI溶液,加入6 mL0.l mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入lmLCCl4充分振荡、静置, CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀:
③第三支试行中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号) ______________;实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号)_______________,由此可以证明该氧化还原反应为___________________(填可逆反应或不可逆反应)。
(2)乙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是__________________________________;生成沉淀的原因是(用平衡移动原理解释)_________________________________________________。
(3)丙组同学模拟工业上用NaClO3氧化酸性FeCl2废液制备FeCl3。
①若酸性FeCl2 废液中:c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为_____________。
②完成NaClO3氧化FeCl2的离子方程式:□ClO3-+□Fe2++□________=□Cl-+□Fe3++□________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com