
【题目】某硫酸工厂排放的尾气中,含少量的二氧化硫。如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量___。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】1,3-丁二烯与HBr发生加成反应分两步:第一步H+进攻1,3-丁二烯生成碳正离子(![]() );第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是
);第二步Br -进攻碳正离子完成1,2-加成或1,4-加成。反应进程中的能量变化如下图所示。已知在0℃和40℃时,1,2-加成产物与1,4-加成产物的比例分别为70:30和15:85。下列说法正确的是
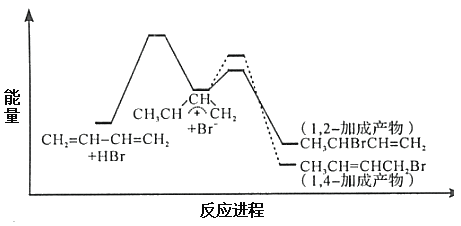
A.1,4-加成产物比1,2-加成产物稳定
B.与0℃相比,40℃时1,3-丁二烯的转化率增大
C.从0℃升至40℃,1,2-加成正反应速率增大,1,4-加成正反应速率减小
D.从0℃升至40℃,1,2-加成正反应速率的增大程度小于其逆反应速率的增大程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属,其焰色反应呈黄色,B溶液能使酚酞试液变红;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:
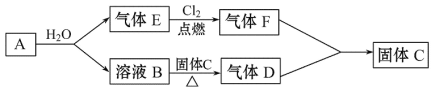
(1)A的名称是___;F的化学式是__。
(2)B→D反应的化学方程式为__。
(3)F在空气中遇水蒸气产生白雾现象,这白雾实际上是__。
(4)已知,气体D也能与Cl2发生反应,试写出当Cl2足量时该反应的化学方程式,并用双线桥法标出电子转移的数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
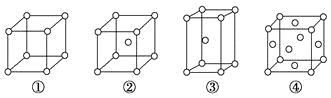
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟磷灰石是常见的钙氟磷酸盐矿物,其化学式为Ca5(PO4)3F,由氟磷灰石制取黄磷(P4)的化学式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),请回答下列问题:
(1)基态Ca原子电子所占据最高能级的电子云轮廓图为________,基态P原子的价电子轨道表达式为________。
(2)由氟磷灰石制取黄磷(P4)产物中属于极性分子的化合物是________,与其互为等电子体的分子为________。
(3)黄磷(P4)晶体的空间结构如图甲所示,P的杂化轨道类型为________,磷的一种硫化物P4S3的空间结构如图乙所示,每个S原子中含有孤电子对的数目为________。


(4)SiO2的沸点________(填“大于”或“小于”)CO2的沸点,其原因为________。
(5)Ca与Ti、O元素形成的化合物的晶胞结构如图所示,则该晶体的化学式为________,若晶胞密度为ρgcm-3,阿伏加德罗常数的值为NA,则该晶胞中两个距离最近的O原子之间的距离为________pm(用含ρ、NA的表达式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,反应方程式为:4HCl(g) + O2(g)![]() 2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
2H2O(g)+ 2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下。下列说法正确的是( )
t/min | 0 | 2 | 4 | 6 |
n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
A.0~2 min的反应速率小于4~6 min的反应速率
B.2~6 min用Cl2表示的反应速率为0.9 mol/(L·min)
C.增大压强可以提高HCl转化率
D.平衡常数K(200℃)<K(400℃)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用![]() 和
和![]() 制备多种物质。请回答下列问题:
制备多种物质。请回答下列问题:
(1)反应Ⅰ:![]() H1平衡常数为K1
H1平衡常数为K1
反应Ⅱ:![]() H2平衡常数为K2
H2平衡常数为K2
不同温度下,K1、K2的值如表所示:
| K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应Ⅲ:![]() H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高
H3平衡常数为K3,结合上表数据分析,K3=________(用K1、K2表示)。反应Ⅲ是________(填“放热”或“吸热”)反应,为提高![]() 的转化率可采取的措施有________(写出任意两条)。
的转化率可采取的措施有________(写出任意两条)。
(2)一定条件下,在密闭容器中充入![]() 和
和![]() 进行如下反应:
进行如下反应:![]()
![]() 。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时
。采用催化剂甲和催化剂乙分别发生上述反应,测得反应进行相同时间时![]() 的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
的转化率随反应温度的变化曲线如图所示(忽略温度对催化剂活性的影响):
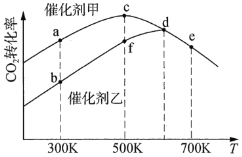
①该可逆反应的反应热H________0(填“>”或“<”)。
②催化剂甲作用下反应的活化能比催化剂乙作用下反应的活化能________(填“大”或“小”)。
③![]() 下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
下达到平衡时,反应在催化剂甲作用下的转化率比在催化剂乙作用下的转化率________(填“高”、“相等”或“低”)
④图中达到平衡的点是________。
(3)工业上常用高浓度的![]() 溶液吸收
溶液吸收![]() ,得到溶液X,再利用电解法使
,得到溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图:
溶液再生,其装置示意图如图:
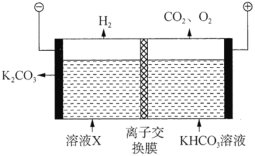
①在阳极区发生的反应有:________和![]() 。
。
②简述![]() 在阴极区再生的原理:________。
在阴极区再生的原理:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂充分利用工业废气中的 CO、CO2,将氯代烃、氯碱工业和甲醇联合生产,减少了环境污染,具体流程如图。下列叙述错误的是
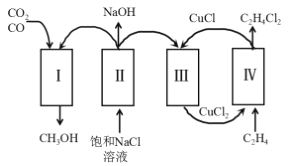
A.为减少副反应的发生,过程Ⅱ中的装置需使用阳离子交换膜
B.在过程Ⅲ中实现了CuCl2 的再生
C.理论上每生成 1molCH3OH,可得到1molC2H4Cl2
D.过程Ⅳ中的反应是C2H4+2CuCl2=C2H4Cl2+2CuCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com