
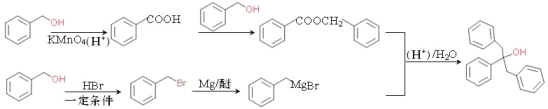
����Ŀ��G �Ǻϳɿ��¹ڲ���ҩ����м��壬�ϳ�·����ͼ��ʾ��
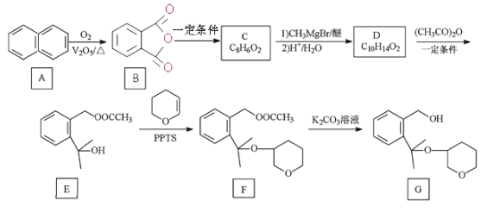
��֪��R1COOR2![]()
 +R2-OH(R��R1��R2�ֱ�Ϊ����)
+R2-OH(R��R1��R2�ֱ�Ϊ����)
�ش��������⣺
(1)G �й����ŵ�����Ϊ____��
(2)C �Ľṹ��ʽΪ____��
(3)д�� D �� E �ķ���ʽ____���÷�Ӧ����Ϊ____��
(4)�� �� F  �е�����̼ԭ��___��
�е�����̼ԭ��___��
(5)H �� G��Ϊͬ���칹�壬д����������������һ�ֽṹ��ʽ____
���ܷ���ˮ�ⷴӦ���ں˴Ź����������֮��Ϊ 2:2:9:9
(6)��֪RX![]() RMgX (X ��ʾ±�� ԭ��) ���Ա��״� Ϊԭ���Ʊ�
RMgX (X ��ʾ±�� ԭ��) ���Ա��״� Ϊԭ���Ʊ� �������ϳ�·��ͼ___(���Լ����л��ܼ���ѡ)��
�������ϳ�·��ͼ___(���Լ����л��ܼ���ѡ)��
���𰸡��ǻ����Ѽ� 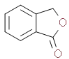
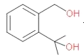 +(CH3CO)2O
+(CH3CO)2O![]()
 +CH3COOH ȡ����Ӧ
+CH3COOH ȡ����Ӧ 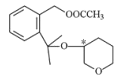
 (��
(�� ��
�� )
) 
��������
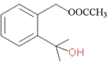
A����������Ӧ����B������C����D�ķ�Ӧ������֪���ù��̷�����Ŀ������Ӧ������C�к����������ٽ��B�Ľṹ��ʽ�Լ�C�ķ���ʽ��֪C�Ľṹ��ʽΪ ��D�Ľṹ��ʽΪ
��D�Ľṹ��ʽΪ ��D����ȡ����Ӧ��E��E������
��D����ȡ����Ӧ��E��E������![]() �����ӳɷ�Ӧ����F��F����ȡ����Ӧ����G��
�����ӳɷ�Ӧ����F��F����ȡ����Ӧ����G��
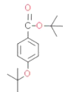
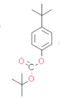
(1)����G�Ľṹ��ʽ��֪�������Ϊ�Ѽ����ǻ���
(2)���ݷ�����֪CΪ ��
��
(3)DΪ ������һ���ǻ��ϵ���ԭ�ӱ���COCH3��������E����ѧ����ʽΪ
������һ���ǻ��ϵ���ԭ�ӱ���COCH3��������E����ѧ����ʽΪ +(CH3CO)2O
+(CH3CO)2O![]()
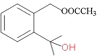 +CH3COOH���÷�Ӧ����ȡ����Ӧ��
+CH3COOH���÷�Ӧ����ȡ����Ӧ��
(4)�����ĸ���ͬ��ԭ�ӻ�ԭ���ŵ�̼ԭ��Ϊ����̼ԭ�ӣ�����F�е�����̼ԭ��Ϊ (*���)��
(*���)��
(5)H��G��Ϊͬ���칹�壬���㣺
���ܷ���ˮ�ⷴӦ������G�Ľṹ��ʽ��֪HӦ����������
�ں˴Ź����������֮��Ϊ2:2:9:9�����䱽����Ӧ���������ڶ�λ�IJ�ͬȡ����(��������2:2)��������������� ��
��  ��
�� ��
��
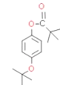
(6)���״�Ϊ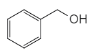 ��Ŀ�����Ϊ
��Ŀ�����Ϊ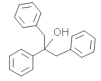 ��������Ŀ����������֪����Ӧ��֪��
��������Ŀ����������֪����Ӧ��֪�� ������
������![]() ��
��![]() �ϳɣ�
�ϳɣ�![]() ������
������ ��
��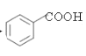 ����������Ӧ���ɣ������״����Ա������ɱ��������RX
����������Ӧ���ɣ������״����Ա������ɱ��������RX![]() RMgX��֪
RMgX��֪![]() ������
������![]() ���ɣ���
���ɣ��� ���Ժ�HBr����ȡ����Ӧ����
���Ժ�HBr����ȡ����Ӧ����![]() ��
��
���������ϳ�·��Ϊ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪0.1mol/L�Ĵ�����Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3COO����H��Ҫʹ��Һ��
CH3COO����H��Ҫʹ��Һ��![]() ֵ�����Բ�ȡ�Ĵ�ʩ��( )
ֵ�����Բ�ȡ�Ĵ�ʩ��( )
A.�������ռ���ҺB.�����¶�
C.������������D.��ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���һ����̼�Ͷ�����̼��ɵĻ������Ϊ6.72 L������Ϊ12g���˻������һ����̼�Ͷ�����̼���ʵ���֮����__________��һ����̼�����������__________��һ����̼������������__________��̼ԭ�Ӻ���ԭ�Ӹ�������__________����������ƽ����Է���������__________���ܶ���__________g��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Ȼ�ѧ����ʽ��д���Ӧ��������ȷ����(����)
A. ϡ������0.1 mol��L NaOH��Һ��Ӧ��H+(aq)+OH��(aq)= H2O(l)��H = +57.3 kJ��mol-1
B. ��101KPa��������ȼ������H =��285.5 kJ��mol-1����ˮ�ֽ���Ȼ�ѧ����ʽ��2H2O(l)=2H2(g)+O2(g) ��H = +285.5 kJ��mol-1
C. ��֪2C(s)+O2(g)=2CO(g) ��H=��221 kJ��mol-1�� ���֪C��ȼ���ȴ���110.5 kJ��mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ��H>0 ��ӦΪ������Ӧ���κ��¶������Է�����
4NO2(g)+O2(g) ��H>0 ��ӦΪ������Ӧ���κ��¶������Է�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�����õĻ���ԭ�ϣ���������SO2���ܼ��ٴ�����Ⱦ�����ܳ��������Դ����ѧ���������Fe3����Fe2�������ӵ����ã��ڳ����½�SO2������SO42-��ʵ��SO2�Ļ������á�ij�о���ѧϰС��������·�������ʵ���������²ⶨת����������Ч�ʣ�
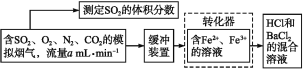
��1��д��Fe3����SO2��Ӧ�����ӷ���ʽ��__��
��2��������ʵ�����ڱ�״���½��еģ����ⶨת�����е�����Ч�ʣ����Ѳ������������ģ��������SO2���������������Ҫ�ⶨ��������___��
��3���������ɫʯ����Һ���Թ���ͨ��SO2���壬������__�����������е�����������ˮ��������__���漰��Ӧ�Ļ�ѧ����ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��ij����ԭ�ӵ�������a g��1��12Cԭ�ӵ�������b g����NA��ʾ�����ӵ�������ֵ������˵������ȷ����(����)
�ٸ���ԭ�ӵ����ԭ������Ϊ12a/b����m g����ԭ�ӵ����ʵ���Ϊm/(aNA) mol���۸���ԭ�ӵ�Ħ��������aNA g����a g����ԭ�������ĵ�����Ϊ17 mol
A.�٢�B.�٢�C.�ڢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
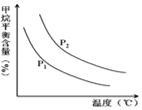
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���������֪������Һ�������廯��(FeBr3)���ڵ������¿ɷ�����Ӧ�����屽���廯�⣬�˷�ӦΪ���ȷ�Ӧ�������������ͼװ����ȡ�屽�������Һ©���м��뱽��Һ�壬�ٽ����Һ�������뷴Ӧ��A�С�
��ͼ����ȡ�屽��װ�á��Իش�

(1)װ��A�з�����Ӧ�Ļ�ѧ����ʽ��_________________________��
(2)װ��C�п�����������____________________��֤��________________________��
(3)װ��B������ƿ����ʢCCl4Һ�壬ʵ���й۲쵽��������________��ԭ����____________��
���û��Bװ�ö���A��Cֱ������������Ϊ�Ƿ�����________(��ǡ���)��������______________________��
(4)ʵ����Ϻ�A�Թ��е�Һ�嵹��װ����ˮ���ձ��У��ձ�______________(��ϡ����¡�)��Ϊ�屽����˵���屽______________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯī�缫������е��ʵ�顣
ʵ��װ�� | ʵ������ |
| a����ֽ������ b����죬�ֲ���ɫ�� c�������Ա仯�� d����ֽ���� |
���ж�ʵ������Ľ��ͻ��Ʋ�����������
A. aΪ���ص�����
B. b�����������ɣ�����ˮ��Ӧ����������ʹ�����
C. c�������˷�Ӧ��Fe-3e�� = Fe3+
D. d����2H2O+2e��=H2��+2OH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com