
【题目】下列热化学方程式中的ΔH最小的是
A. NaOH (aq) + HCl (aq) ===NaCl (aq) + H2O (l) ΔH1
B. NaOH (aq) + ![]() H2SO4 (aq) ===
H2SO4 (aq) ===![]() Na2SO4 (aq) + H2O (l) ΔH2
Na2SO4 (aq) + H2O (l) ΔH2
C. CH3COOH (aq) + NaOH (aq) ===CH3COONa (aq) + H2O (l) ΔH3
D. NaOH (aq) + ![]() H2SO4 (浓) ===
H2SO4 (浓) ===![]() Na2SO4 (aq) + H2O (l) ΔH4
Na2SO4 (aq) + H2O (l) ΔH4
科目:高中化学 来源: 题型:
【题目】某学习小组设计以下三个实验探究氯水的组成,请根据下表回答问题。
实验序号 | 实验方法 | 实验现象 | 结论 |
① | 将氯水滴加到AgNO3溶液中 | a: | 氯水中含有Cl- |
② | 将氯水滴加到含酚酞的NaOH溶液中 | 红色溶液 变为无色 | …… |
③ | 将氯水滴加到Na2CO3溶液中 | b: | 氯水中含有H+ |
(1)写出实验①和③的实验现象。
a:________________,b:________________。
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸,你是否同意这个观点?________(填“同意”或“不同意”),理由是________________________________________________。
(3)在分析实验②中实验现象产生的原因时,同学们的意见出现了分歧。甲同学认为氯水加到NaOH溶液中发生了中和反应而使溶液退色,乙同学认为氯水中含有的次氯酸具有漂白性而使溶液褪色。请你设计简单的实验证明他们的观点:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
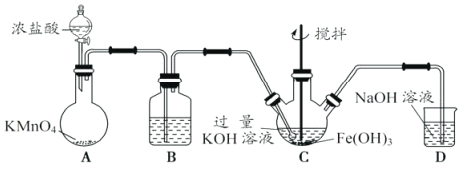
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为__________.
(2)B为0.1mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因__________.
(3)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:
①100 mL 蒸馏水中; ②100 mL 0.2 mol·L-1 AgNO3溶液中;
③100 mL 0.1 mol·L-1氯化铝溶液中; ④100 mL 0.1 mol·L-1盐酸溶液中,
充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为______ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语不正确的是
A. N2的电子式:![]()
B. HClO的结构式:H—O—Cl
C. 核内有10个中子的氧原子构成的某种离子:188O22—
D. 醋酸的电离方程式:CH3COOH+H2O![]() CH3COO+H3O+
CH3COO+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,向2m g 16%的CuSO4溶液中加入m g CuSO45H2O,溶液恰好达到饱和,该饱和溶液中CuSO4的质量分数为_____。
(2)标准状况下,1体积水可溶解V体积HCl气体,所得溶液的密度为ρg/cm3,则所得溶液溶质的质量分数表示为_____,溶质的物质的量浓度表示为_____。
(3)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1硫酸溶液的溶质的质量分数,且知 2a=b,则下列推断正确的是(硫酸溶液的密度比纯水的大)_____(填序号)
A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1
(4)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1氨水的溶质的质量分数,且知2ω1=ω2,则下列推断正确的是(氨水的密度比纯水的小)_____(填序号)
A. 2a=b B. 2a<b C. 2a>b D. a<b<2a.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:

(1)图中未画出的实验器材是________________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
序号 | 反应物 | 起始温度t1/ oC | 终止温度t2/ oC | 中和热 |
① | HCl+NaOH | 14.8 | 18.3 | ΔH1 |
② | HCl+NaOH | 15.1 | 19.7 | ΔH1 |
③ | HCl+NaOH | 15.2 | 18.5 | ΔH1 |
④ | HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①试计算上述两组实验测出的中和热ΔH1=______________。
②某小组同学为探究强酸与弱碱的稀溶液反应时的能量变化,又多做了一组实验④,用0.55mol·L-1的稀氨水代替NaOH溶液,测得温度的变化如表中所列,试计算反应的ΔH2=____________。
③两组实验结果差异的原因是___________________________________________。
④写出HCl+NH3· H2O反应的热化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水(主要是水和氯化钠,还有少量的镁离子等)中提取镁,可按如下步骤进行:
①把贝壳(主要成分碳酸钙)制成石灰乳(氢氧化钙的悬浊液);
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物(主要是氢氧化镁);
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物,得到氯化镁产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是
A. 向海水中加入硝酸银会产生白色沉淀
B. 步骤②中涉及到的离子反应方程式为2OH-+Mg2+=Mg(OH)2↓
C. ①②③步骤涉及化合、分解和复分解反应
D. 第④步的反应属于分解反应也是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com