
����Ŀ��������ˮ�п��ܴ��ڵ���ƽ�⡢�ε�ˮ��ƽ��ͳ������ܽ�ƽ��,���Ƕ��ɿ�����ѧƽ�⡣�������ѧ֪ʶ�ش�:
(1)AΪ0.1 mol��L-1��(NH4)2SO4��Һ,�ڸ���Һ�и������ӵ�Ũ���ɴ�С��˳��Ϊ__________.
(2)BΪ0.1mol��L-1 NaHCO3��Һ,�����NaHCO3��Һ�Լ��Ե�ԭ��__________.
(3)DΪ��������AgCl����ı�����Һ,�Ȼ�����ˮ�д��ڳ����ܽ�ƽ��:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
��25 ��ʱ,�Ȼ�����Ksp=1.8��10-10���ֽ������Ȼ����ֱ������
��100 mL ����ˮ��; ��100 mL 0.2 mol��L-1 AgNO3��Һ��;
��100 mL 0.1 mol��L-1�Ȼ�����Һ��; ��100 mL 0.1 mol��L-1������Һ��,
��ֽ����,��ͬ�¶���������Ũ���ɴ�С��˳����________(��д���);���������ӵ�Ũ��Ϊ______ mol��L-1
���𰸡� c(NH4+)>c(SO42-)>c(H+)>c(OH-) ![]() ��ˮ��̶ȴ��������̶���Һ��c(OH-)>c(H+) �ڢ٢ܢ� 9��10-10
��ˮ��̶ȴ��������̶���Һ��c(OH-)>c(H+) �ڢ٢ܢ� 9��10-10
��������
(1) (NH4)2SO4����ǿ�������Σ�����Һ��(NH4)2SO4=2NH4++SO42-��NH4++H2O![]() NH3H2O+H+��ˮ��������H2O
NH3H2O+H+��ˮ��������H2O![]() H++OH-��NH4+��ʼŨ����SO42-��2������ˮ�������ģ�����NH4+Ũ���Դ���SO42-Ũ�ȣ�����Һ������Ũ���ɴ�С��˳��Ϊc(NH4+)>c(SO42-)>c(H+)>c(OH-)��
H++OH-��NH4+��ʼŨ����SO42-��2������ˮ�������ģ�����NH4+Ũ���Դ���SO42-Ũ�ȣ�����Һ������Ũ���ɴ�С��˳��Ϊc(NH4+)>c(SO42-)>c(H+)>c(OH-)��
(2)NaHCO3���������ʽ�Σ�Ҳ��ǿ�������Σ��ȴ�����ʽ���ĵ���HCO3-![]() H++CO32-���ִ�����ʽ����ˮ�ⷴӦHCO3-+H2O
H++CO32-���ִ�����ʽ����ˮ�ⷴӦHCO3-+H2O![]() H2CO3+OH-��ˮ��̶ȴ��ڵ���̶ȣ�ʹ��Һ��c(OH-)>c(H+)��������Һ�ʼ��ԡ�
H2CO3+OH-��ˮ��̶ȴ��ڵ���̶ȣ�ʹ��Һ��c(OH-)>c(H+)��������Һ�ʼ��ԡ�
(3)���Ȼ����ܽ�Ⱥ�С����Һ�м����Ȼ���������Ϊ��Һ������䣬�Ȼ�����ˮ�дﵽ�����ܽ�ƽ��:AgCl(s)![]() Ag+(aq)+Cl-(aq)ʱ��
Ag+(aq)+Cl-(aq)ʱ��![]() ��
��
��������ˮ��![]() �����Ȼ����ܽ�Ⱥ�С��AgCl�ܽ��Ag+�ɺ��ԣ���0.2 mol��L-1 AgNO3��Һ��c(Ag+)=0.2mol/L����0.1 mol��L-1�Ȼ�����Һ��c(Cl-)=0.3mol/L������AgCl��Cl-������
�����Ȼ����ܽ�Ⱥ�С��AgCl�ܽ��Ag+�ɺ��ԣ���0.2 mol��L-1 AgNO3��Һ��c(Ag+)=0.2mol/L����0.1 mol��L-1�Ȼ�����Һ��c(Cl-)=0.3mol/L������AgCl��Cl-������![]() ����0.1 mol��L-1������Һ��c(Cl-)=0.1mol/L��
����0.1 mol��L-1������Һ��c(Cl-)=0.1mol/L��![]() ���ɴ˿�֪������Ũ���ɴ�С��˳���ǣ��ڢ٢ܢۡ������Һ��c(Ag+)=0.2mol/L������
���ɴ˿�֪������Ũ���ɴ�С��˳���ǣ��ڢ٢ܢۡ������Һ��c(Ag+)=0.2mol/L������![]() ��
��


 ������ϵ�д�
������ϵ�д� �±�Сѧ��Ԫ�Բ���ϵ�д�
�±�Сѧ��Ԫ�Բ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�Ͽ����ұ���������ϩ�� ������˵����ȷ����
������˵����ȷ����
A. �÷�Ӧ������Ϊ��ȥ��Ӧ
B. �ұ���ͬ���칹�干������
C. ����Br2/CCl4�����ұ��ͱ���ϩ
D. �ұ��ͱ���ϩ�����ڹ�ƽ���̼ԭ������Ϊ7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�Ϊ���顣
��1����ҵ�Ͽ���ú����Ȼ���������������ж���;������CH4��
д��CO��H2��Ӧ����CH4��H2O���Ȼ�ѧ����ʽ____________
��֪�� CO(g)+H2O(g)![]() H2(g)+CO2(g) ��H����41kJ��mol��1
H2(g)+CO2(g) ��H����41kJ��mol��1
C(s)+2H2(g)![]() CH4(g) ��H����73kJ��mol��1
CH4(g) ��H����73kJ��mol��1
2CO(g)![]() C(s)+CO2(g) ��H����171kJ��mol��1
C(s)+CO2(g) ��H����171kJ��mol��1
��2����Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��ͨ��������õ�������ʹ����Һ������д��������Ӧ�Ļ�ѧ����ʽ________________________ ��
��3����Ȼ����һ����Ҫ��;����ȡH2����ԭ��Ϊ��CO2(g)��CH4(g)![]() 2CO(g)��2H2(g)�����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L��1��CH4��CO2����һ�������·�����Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ1��ʾ����ѹǿP1_________P2������ڡ���С�ڡ�����ѹǿΪP2ʱ����Y�㣺v(��)___________v(��)������ڡ�����С�ڡ����ڡ�����
2CO(g)��2H2(g)�����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L��1��CH4��CO2����һ�������·�����Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ1��ʾ����ѹǿP1_________P2������ڡ���С�ڡ�����ѹǿΪP2ʱ����Y�㣺v(��)___________v(��)������ڡ�����С�ڡ����ڡ�����

��4���Զ������ѱ��渲��CuAl2O4Ϊ���������Խ�CH4��CO2ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ2��ʾ��250~300��ʱ���¶����߶�������������ʽ��͵�ԭ����________________��
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.ijͬѧ�����ͼ��ʾװ��̽�������ܷ���ˮ������Ӧ������a����Ҫ�ɷ��Ǻ�������ˮ��������������ش��������⣺


��1������a����ͼ�����Ʊ� ����ѡ��ͼ�еļ�װ�ã���Ӧ�����ӷ���ʽ��_____����ѡ��װ���ң����еĵ��� a ��������_____��
��2��֤��������ˮ������Ӧ��ʵ������Ϊ_____________��
��3����ʵ����ƴ���ȱ�ݣ�Ϊ�˿˷���ȱ�ݣ���Ҫ����װ��D�����з�����Ӧ�����ӷ���ʽΪ_________________��
II.��ͼΪŨ������ͭ��Ӧ�����������ʵ��װ��

�ش��������⣺
��1��ָ���Թ�c�в�����ʵ������______________________��
��2�� �ÿɳ鶯��ͭ˿����ͭƬ���ŵ�___________��
��3��д��Ũ������ͭ��Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ظ�(Cr)����Ȼ����Ҫ��+3�ۺ�+6�۴��ڡ�
��1��+6�۵�Cr������ϸ����ͻ��������岻���������������ƽ��仹ԭ�����ӷ�Ӧ����ʽΪ��3SO32��+Cr2O72��+8H+===2Cr3++3SO42��+4H2O���÷�Ӧ�������ͻ�ԭ�������ʵ���֮��Ϊ___________��
��2����ҵ�����ø�����( FeO. Cr2O3)ұ�����Ĺ���������ͼ��ʾ��
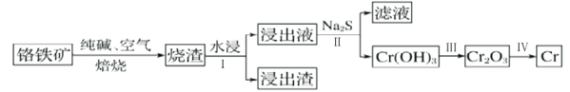
��Ϊ�ӿ챺�����ʺ����ԭ�ϵ������ʣ��ɲ�ȡ�Ĵ�ʩ֮һ��___________��
��ˮ����Ҫ��ý���Һ�IJ�����___________��
�۽���Һ����Ҫ�ɷ�ΪNa2CrO4������Na2S��Ӧ����Na2SO4���ɣ��������������Ӧ�����ӷ���ʽΪ___________��
��3��������Cr(OH)3���ܶȻ�Ksp=1��10��32����ҪʹCr3+��ȫ����pHΪ___________[c(Cr3+)����10��5mol��L��1����Ϊ��ȫ����]��
��4���Ը�����(Na2CrO4)Ϊԭ�ϣ��õ绯ѧ�����Ʊ��ظ�����(Na2Cr2O7)��ʵ��װ����ͼ��ʾ(��֪��2CrO42��+2H+=Cr2O72��+H2O)��
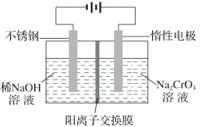
�������ĵ缫��ӦʽΪ___________��
�ڵ��һ��ʱ������������Һ��Na+���ʵ�����amol��Ϊbmol���������ظ����Ƶ����ʵ���Ϊ___________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�е���H��С����
A. NaOH (aq) + HCl (aq) ===NaCl (aq) + H2O (l)�� ��H1
B. NaOH (aq) + ![]() H2SO4 (aq) ===
H2SO4 (aq) ===![]() Na2SO4 (aq) + H2O (l)�� ��H2
Na2SO4 (aq) + H2O (l)�� ��H2
C. CH3COOH (aq) + NaOH (aq) ===CH3COONa (aq) + H2O (l)�� ��H3
D. NaOH (aq) + ![]() H2SO4 (Ũ) ===
H2SO4 (Ũ) ===![]() Na2SO4 (aq) + H2O (l)�� ��H4
Na2SO4 (aq) + H2O (l)�� ��H4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ֱ��ʾ�йط�Ӧ�ķ�Ӧ�����������仯�Ĺ�ϵ��


�ݴ��ж�����˵������ȷ����(����)
A. ʯīת��Ϊ���ʯ�����ȷ�Ӧ B. ���ױȺ����ȶ�
C. S(g)��O2(g)===SO2(g)����H1S(s)��O2(g)=SO2(g)����H2������H1>��H2 D. CO(g)��H2O(g)=CO2(g)��H2(g)����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��ĸ����õĵ绯ѧװ�õ���������ȷ����(����)
A.ͼ ��ʾ����п�̵���У�MnO2�Ǵ���
��ʾ����п�̵���У�MnO2�Ǵ���
B.ͼ ��ʾǦ���طŵ�����У�����Ũ�ȱ��ֲ���
��ʾǦ���طŵ�����У�����Ũ�ȱ��ֲ���
C.ͼ ��ʾ��⾫��ͭװ�ù��������У��������Һ��Cu2+Ũ�Ȳ�������
��ʾ��⾫��ͭװ�ù��������У��������Һ��Cu2+Ũ�Ȳ�������
D.ͼ ��ʾŦ��ʽп����ع��������У����·�е�����п��������������
��ʾŦ��ʽп����ع��������У����·�е�����п��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��һ����Ҫ�Ļ�����Ʒ���������л��ϳɴ����������������ϣ������ȹ�ҵ���������ϵ�֪��CuCl��һ�ְ�ɫ���壬����ˮ�������ھƾ���������Ũ���ᣬ�������ﵼ���Ժܲ
(1)CuClΪ__________(�������ۻ��������������ӻ�������)��
(2)��CuCl2��Һ����μ������ KI��Һ���ܷ�����
a.2Cu2++4I-=2CuI��(��ɫ)+I2
b.2Cu2++2Cl-+2I-=2CuCl��(��ɫ)+I2
��a��ӦΪ��Ҫ��Ӧ����Ksp(CuI)________Ksp(CuCl)����������������������=������
(3)ʵ���ҿ����Ȼ�ͭ��Һ��ͭ�ۡ�Ũ���ᷴӦ�Ʊ��Ȼ���ͭ���䷴Ӧԭ��������Ϊ��
CuCl2+Cu+2HCl(Ũ)![]() 2HCuCl2(��ɫ)
2HCuCl2(��ɫ)![]() 2CuCl��(��ɫ)+2HCl
2CuCl��(��ɫ)+2HCl
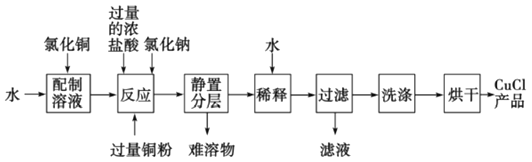
��������Ӧ�����У������Ȼ��Ƶ�Ŀ����________________________��
�ڳ����£�CuOH��KspΪ1.0��10-14����Cu++H2O![]() CuOH+H+��ƽ�ⳣ��Ϊ��________
CuOH+H+��ƽ�ⳣ��Ϊ��________
��Ϊ�õ�������CuCl���壬���ѡ��__________�����ţ��Լ�����ϴ�ӡ�
a������ˮ b��ϡ���� c���Ȼ�ͭ��Һ d���Ҵ�
��CuCl�ڳ�ʪ�Ļ������ױ�����ΪCu2(OH)3Cl����Ӧ�Ļ�ѧ����ʽΪ__________��ʵ��ʱ������2mL0.5mol/L��CuCl2 ��Һ�����տɵõ���Ʒ0.16g����ʵ��IJ���Ϊ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com