
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业。查阅资料得知:CuCl是一种白色固体,微溶于水,不溶于酒精,能溶于浓盐酸,其熔融物导电性很差。
(1)CuCl为__________(填“共价化合物”或“离子化合物”)。
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)________Ksp(CuCl)(填“>”、“<”或“=”=)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓)![]() 2HCuCl2(无色)
2HCuCl2(无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
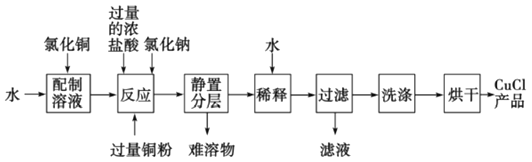
①上述反应流程中,加入氯化钠的目的是________________________。
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O![]() CuOH+H+的平衡常数为:________
CuOH+H+的平衡常数为:________
③为得到纯净的CuCl晶体,最好选用__________(填编号)试剂进行洗涤。
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为__________。实验时,若用2mL0.5mol/L的CuCl2 溶液,最终可得到产品0.16g,则实验的产率为__________。
【答案】共价化合物 < 增大Cl-浓度,有利于生成HCuCl2 l d 4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl 80.4%
【解析】
(1) CuCl熔融物导电性很差,说明物质中几乎无离子,以分子形式存在,故CuCl为共价化合物;
(2)根据方程式可知:当加入KI溶液少量时发生b反应,产生CuCl沉淀,当加入KI溶液过量时,发生反应a,沉淀为CuI,说明难溶物向更难溶性的物质转化,即Ksp(CuI)<Ksp(CuCl);
(3)①在制备CuCl的过程中加入氯化钠,CuCl2+Cu+2HCl(浓)![]() 2HCuCl2(无色),增大了Cl-浓度,使化学平衡向生成HCuCl2的方向移动,有利于得到更多的HCuCl2;
2HCuCl2(无色),增大了Cl-浓度,使化学平衡向生成HCuCl2的方向移动,有利于得到更多的HCuCl2;
②常温下,CuOH的Ksp为1.0×10-14,则c(Cu+)c(OH-)=1.0×10-14,c(Cu+)=c(OH-)=1.0×10-7,室温下水的离子积常数为1.0×10-14,所以c(H+)=1.0×10-7。Cu++H2O![]() CuOH+H+的平衡常数为Kh=
CuOH+H+的平衡常数为Kh=![]() ;
;
③CuCl是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸,乙醇洗涤可以减少CuCl的损失,合理选项是d;
④CuCl在潮湿的环境中与H2O、O2反应产生Cu2(OH)3Cl,根据电子守恒、原子守恒,可得反应的化学方程式为4CuCl+O2+4H2O=2Cu2(OH)3Cl+2HCl;
n (CuCl2)= 0.5mol/L×0.002L=0.001mol,根据Cl元素守恒,可得n[CuCl]=0.002mol,理论上得到CuCl质量为m[CuCl]=0.002mol×98.95g/mol=0.1978g,实际产生0.16g,所以实验的产率为![]() 80.4%。
80.4%。


科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为__________.
(2)B为0.1mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因__________.
(3)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:
①100 mL 蒸馏水中; ②100 mL 0.2 mol·L-1 AgNO3溶液中;
③100 mL 0.1 mol·L-1氯化铝溶液中; ④100 mL 0.1 mol·L-1盐酸溶液中,
充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为______ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)如图为上述反应的浓度—时间图像,由图像判断反应进行至t2时刻时,改变的条件是_________________________,如图为上述反应的速率—时间图像,表示上述反应在t1时达到平衡, 在t2时因改变某个条件而使曲线发生变化。由图判断,t2时刻曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂
c.通入O2 d.缩小容器体积

(2)工业上可利用上述反应的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①一定温度下,在容积为1L的密闭容器中,充入2 mol CO2和4 mol H2,一段时间后达到平衡,测得CH3OH的物质的量浓度为1mol/L,则该温度下此反应的平衡常数为_________,某时刻测得CO2、H2、CH3OH和H2O的物质的量分别为2mol,1mol,1mol,1mol,则这一时刻v(正)___________v(逆)
②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,充分反应达到平衡后,CO2转化率为α,则容器内的压强与起始压强之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是
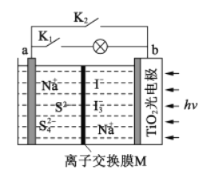
A. 充电时,太阳能转化为化学能,化学能又转化为电能
B. 放电时,a极为正极
C. 充电时,阳极的电极反应式为3I--2e-=I3-
D. M可以使用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水(主要是水和氯化钠,还有少量的镁离子等)中提取镁,可按如下步骤进行:
①把贝壳(主要成分碳酸钙)制成石灰乳(氢氧化钙的悬浊液);
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物(主要是氢氧化镁);
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物,得到氯化镁产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是
A. 向海水中加入硝酸银会产生白色沉淀
B. 步骤②中涉及到的离子反应方程式为2OH-+Mg2+=Mg(OH)2↓
C. ①②③步骤涉及化合、分解和复分解反应
D. 第④步的反应属于分解反应也是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向V mL 0.1 mol/L氨水中滴加等物质的量浓度的稀H2SO4,测得混合溶液的温度和pOH [pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法不正确的是
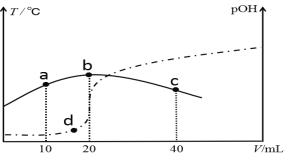
A. V =40
B. b点时溶液的pOH > pH
C. a、b、c三点由水电离的c(H+)依次减小
D. a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
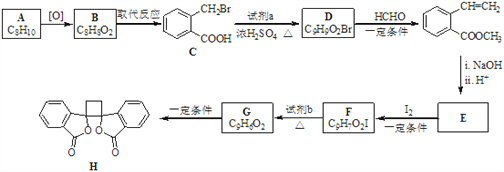
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()

(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成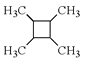 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )

A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com