
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )

A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
【答案】B
【解析】
由图像分析,甲物质溶解度随温度升高而增大,乙物质溶解度受温度变化影响不大,丙物质溶解度随温度升高而降低;图2是在30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,所以试管1中为丙,试管2为甲或乙。
A. 在描述溶解度时,要指明对应温度,因此在不同温度下甲物质的溶解度不一定比乙物质的溶解度大,故A错误;
B. 加入试管1的固体是丙,故B正确;
C. 试管2可能为甲或乙,向烧杯中加入NH4NO3固体后,试管2中不一定有晶体析出,故C错误;
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙,故D错误;
故答案选B。


科目:高中化学 来源: 题型:
【题目】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料,防腐等工业。查阅资料得知:CuCl是一种白色固体,微溶于水,不溶于酒精,能溶于浓盐酸,其熔融物导电性很差。
(1)CuCl为__________(填“共价化合物”或“离子化合物”)。
(2)在CuCl2溶液中逐滴加入过量 KI溶液可能发生:
a.2Cu2++4I-=2CuI↓(白色)+I2
b.2Cu2++2Cl-+2I-=2CuCl↓(白色)+I2
若a反应为主要反应,则Ksp(CuI)________Ksp(CuCl)(填“>”、“<”或“=”=)
(3)实验室可用氯化铜溶液、铜粉、浓盐酸反应制备氯化亚铜,其反应原理和流程为:
CuCl2+Cu+2HCl(浓)![]() 2HCuCl2(无色)
2HCuCl2(无色)![]() 2CuCl↓(白色)+2HCl
2CuCl↓(白色)+2HCl
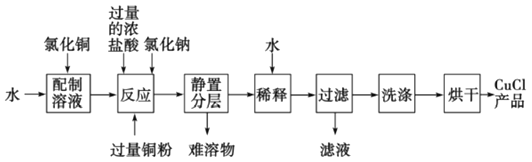
①上述反应流程中,加入氯化钠的目的是________________________。
②常温下,CuOH的Ksp为1.0×10-14,则Cu++H2O![]() CuOH+H+的平衡常数为:________
CuOH+H+的平衡常数为:________
③为得到纯净的CuCl晶体,最好选用__________(填编号)试剂进行洗涤。
a.蒸馏水 b.稀硫酸 c.氯化铜溶液 d.乙醇
④CuCl在潮湿的环境中易被氧化为Cu2(OH)3Cl,反应的化学方程式为__________。实验时,若用2mL0.5mol/L的CuCl2 溶液,最终可得到产品0.16g,则实验的产率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g) ![]() 2C(g),根据下表中的数据判断下列图像错误的是
2C(g),根据下表中的数据判断下列图像错误的是
压强 A的转化率 温度 | P1(MPa) | P2(MPa) |
400℃ | 99.6% | 99.7% |
500℃ | 96.9% | 97.8% |
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式与事实相符且书写正确的是( )
A. 炼铁高炉中生成铁:3C+2Fe2O3![]() 4Fe+3CO2↑
4Fe+3CO2↑
B. 铝放入稀硫酸中:Al+H2SO4=AlSO4+H2↑
C. 向氢氧化钠溶液中加入硫酸铜溶液:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
D. 向小苏打中滴加稀硫酸: Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g) ![]() 4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) ΔH>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500 s内NO2的生成速率为2.96×10-3 mol·L-1·s-1
B. T1温度下该反应平衡时NO2的产率为25%
C. 达到平衡后,其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)<5.00 mol·L-1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过如下反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________(用K1和K2表示)。
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl—N===O):
化学键 | N≡O | Cl—Cl | Cl—N | N===O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
(3)按投料比2∶1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图(a)所示:
①该反应的ΔH________(填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。


(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),在n(NO)/n(Cl2)=1.5时达到平衡状态,ClNO的体积分数可能是图(b)中D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 向0.1 mol·L1 Na2CO3溶液中通入适量CO2气体后:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. 常温下,pH=6的NaHSO3溶液中:c(![]() )c(H2SO3)=9.9×107 mol·L1
)c(H2SO3)=9.9×107 mol·L1
C. 等物质的量浓度、等体积的Na2CO3和NaHCO3混合:![]() <
<![]()
D. 0.1 mol·L1 Na2C2O4溶液与0.1 mol·L1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g) ![]() cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是
cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是

A. T1>T2,Q>0
B. T2>T1,Q>0
C. P1<P2,a+b=c+d
D. P1<P2,b=c+d
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com