
����Ŀ����������(ClNO)���л��ϳ��е���Ҫ�Լ�����ͨ�����·�Ӧ��ã�2NO(g)��Cl2(g) ![]() 2ClNO(g)��
2ClNO(g)��
��1�����������������ڴ����еĺ������������ʱ�������������ȣ��漰���·�Ӧ��
��2NO2(g)��NaCl(s) ![]() NaNO3(s)��ClNO(g)��K1
NaNO3(s)��ClNO(g)��K1
��4NO2(g)��2NaCl(s) ![]() 2NaNO3(s)��2NO(g)��Cl2(g)��K2
2NaNO3(s)��2NO(g)��Cl2(g)��K2
��2NO(g)��Cl2(g) ![]() 2ClNO(g)��K3
2ClNO(g)��K3
��K3��________(��K1��K2��ʾ)��
��2����֪���ֻ�ѧ���ļ����������±�(�������ȵĽṹΪCl��N===O)��
��ѧ�� | N��O | Cl��Cl | Cl��N | N===O |
����/(kJ��mol��1) | 630 | 243 | a | 607 |
��2NO(g)��Cl2(g) ![]() 2ClNO(g)��Ӧ�Ħ�H��a�Ĺ�ϵΪ��H��_______kJ��mol��1��
2ClNO(g)��Ӧ�Ħ�H��a�Ĺ�ϵΪ��H��_______kJ��mol��1��
��3����Ͷ�ϱ�2��1��NO��Cl2���뵽һ��ѹ���ܱ������з�����Ӧ��ƽ��ʱNO��ת�������¶�T��ѹǿp(��ѹ)�Ĺ�ϵ��ͼ(a)��ʾ��
�ٸ÷�Ӧ�Ħ�H________(�>����<������)0��
����pѹǿ�����£�M��ʱ������NO���������Ϊ________��
������Ӧһֱ������pѹǿ�����½��У���M��ķ�ѹƽ�ⳣ��Kp��________(�ú�p�ı���ʽ��ʾ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ���������)��
 ��
��
��4��һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)����n(NO)/n(Cl2)��1.5ʱ�ﵽƽ��״̬��ClNO���������������ͼ(b)��D��E��F�����е�________�㡣
���𰸡�K3=K12/K2 +(289-2a) < 40% 5/p D
��������
��1����֪����2NO2��g��+NaCl��s��![]() NaNO3��s��+ClNO��g������4NO2��g��+2NaCl��s��
NaNO3��s��+ClNO��g������4NO2��g��+2NaCl��s��![]() 2NaNO3��s��+2NO��g��+Cl2��g�������١�2-�ڿɵã�2NO��g��+Cl2��g��
2NaNO3��s��+2NO��g��+Cl2��g�������١�2-�ڿɵã�2NO��g��+Cl2��g��![]() 2ClNO��g������ƽ�ⳣ��K3=K12/K2���ʴ�Ϊ��K3=K12/K2��
2ClNO��g������ƽ�ⳣ��K3=K12/K2���ʴ�Ϊ��K3=K12/K2��
��2��2NO��g��+C12��g��![]() 2C1NO��g����Ӧ�ġ�H=��Ӧ��ļ���֮��-������ļ���֮��=��2��630+243��-��2a+2��607��=��289-2a��kJ/mol���ʴ�Ϊ��289-2a��
2C1NO��g����Ӧ�ġ�H=��Ӧ��ļ���֮��-������ļ���֮��=��2��630+243��-��2a+2��607��=��289-2a��kJ/mol���ʴ�Ϊ��289-2a��
��3���ٸ���ͼ���֪T1<T2�������¶�c��C1NO������˵��ƽ��������Ӧ�����ƶ���˵������Ӧ�Ƿ��ȷ�Ӧ����H<0���ʴ�Ϊ��<��
������ʼn(NO)Ϊ2mol��n(Cl2)Ϊ1mol����ͼ��֪NOת����Ϊ50%�������⽨����������ʽ��
2NO��g��+Cl2��g��![]() 2ClNO��g��
2ClNO��g��
��ʼ��mol�� 2 1 0
��Ӧ��mol�� 1 0.5 1
ƽ�⣨mol�� 1 0.5 1
ƽ��ʱ�������������ʵ���Ϊ2.5mol����M��ʱ������NO���������Ϊ1mol/2.5mol��100%=40%,�ʴ�Ϊ��40%��
��������ʽ���ݼ���ɵã�NO���������Ϊ40%��Cl2���������Ϊ20%��ClNO���������Ϊ40%����M��ķ�ѹƽ�ⳣ��Kp����0.4p��2/��0.4p��2����0.2p��=5/p���ʴ�Ϊ��5/p��
��4��n(NO)/n(Cl2)�ı�ֵԽС��˵����n��NO�����䣬n��C12��Խ������NO��ת����Խ��NO��ת����������A�㣻����Ӧ������ʵ���֮�ȵ����������֮��ʱ�����ַ�Ӧ���ת������ͬ���ʴ�ʱ������İٷֺ������n(NO)/n(Cl2) ����1.5ʱ����İٷֺ�����������Ӧ����D�㣬�ʴ�Ϊ��D��


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����Ҫ��ˮ���Ȼ��ƣ�����������þ���ӵȣ�����ȡþ���ɰ����²�����У�
�ٰѱ��ǣ���Ҫ�ɷ�̼��ƣ��Ƴ�ʯ���飨�������Ƶ�����Һ����
��������ĺ�ˮ�м���ʯ���飬���������ˡ�ϴ�ӳ������Ҫ��������þ����
�۽������������ᷴӦ���ᾧ���ˡ���HCl�����Χ�и������õ��Ȼ�þ���
�ܽ��õ��IJ������ڵ��õ�þ��
����˵������ȷ����
A. ��ˮ�м����������������ɫ����
B. ��������漰�������ӷ�Ӧ����ʽΪ2OH��+Mg2��=Mg(OH)2��
C. �٢ڢ۲����漰���ϡ��ֽ���ֽⷴӦ
D. �ڢܲ��ķ�Ӧ���ڷֽⷴӦҲ��������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1 L�����ܱ������м���1 mol��N2(g)��3 mol H2(g)������Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����H<0��NH3�����ʵ�����ʱ��Ĺ�ϵ�����ʾ������˵���������(����)
2NH3(g)����H<0��NH3�����ʵ�����ʱ��Ĺ�ϵ�����ʾ������˵���������(����)
ʱ��/min | 0 | t1 | t2 | t3 |
NH3���ʵ���/mol | 0 | 0.2 | 0.3 | 0.3 |
A. 0��t1 min��v(NH3)��0.2/t1 mol��L��1��min��1
B. �����¶ȣ���ʹ����Ӧ���ʼ�С���淴Ӧ��������ƽ�������ƶ�
C. N2(g)��3H2(g)![]() 2NH3(g)�Ļ��С��2NH3(g)
2NH3(g)�Ļ��С��2NH3(g)![]() N2(g)��3H2(g)�Ļ��
N2(g)��3H2(g)�Ļ��
D. t3 minʱ�ټ���1 mol��N2(g)��3 mol H2(g)����Ӧ�ﵽ��ƽ��ʱ��c(N2)>0.85 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:��2H2(g)+O2(g)![]() 2H2O(l)����H=-571.6 kJ��mol-1
2H2O(l)����H=-571.6 kJ��mol-1
��2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)����H=-1 452 kJ��mol-1
2CO2(g)+4H2O(l)����H=-1 452 kJ��mol-1
��H+(aq)+OH-(aq)![]() H2O(l)����H=-57.3 kJ��mol-1
H2O(l)����H=-57.3 kJ��mol-1
����˵����ȷ����
A. H2(g)��ȼ����Ϊ142.9 kJ��mol-1
B. ͬ������H2(g)��CH3OH(l)��ȫȼ��,H2(g)�ų���������
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l)����H=-57.3 kJ��mol-1
1/2BaSO4(s)+H2O(l)����H=-57.3 kJ��mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l)����H=+131.4 kJ��mol-1
CH3OH(l)+H2O(l)����H=+131.4 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1�Ǽס��ҡ������ֹ������ʵ��ܽ�����ߣ�ͼ2��30��ʱ��ȡ�������ֹ����1g�ֱ�Ž�ʢ��10gˮ����֧�Թ��У��������ܽ����������˵����ȷ���ǣ� ��

A. �����ʵ��ܽ�ȱ������ʵ��ܽ�ȴ�
B. �����Թ�1�Ĺ����DZ�
C. ���ձ��м���NH4NO3������Թ�2��һ���о�������
D. ��30��ʱ�ס��ҡ����������ʵı�����Һ��100g������20�棬������Һ�����ʵ����������Ĵ�С��ϵ���ң���=��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ѧ����ѧϰ��ͬѧ�Ƕ��������Ļ����������˽�һ���˽⡣
��1������H��C��N��O��K����Ԫ�أ���ѡ�����е�Ԫ��д���������ʵĻ�ѧʽ��
����Ȼ������Ҫ�ɷ�____��
�ڼ�����Ѫ�쵰��ϵ��ж�����____��
���ܹ�������������____��
�ܿ������Ϸʵ������____��
��2����ͼ��ij��ʯ��Ʒ�и���Ԫ�غ����ı���ͼ��

�ٸ���ʯ�к�____�ַǽ���Ԫ�أ����к�����������____Ԫ�ء�
�������ӵĽṹʾ��ͼΪ ����X��____��
����X��____��
�۴���ʯ��Ʒ�в����ܺ��еĻ�������____��
A��CaCO3 B��K2SO4 C��Al2O3 D��SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ��ʵ�飬��x���ʾ���������ĵ��ӵ����ʵ�������y��Ӧ��ʾ( )
��c(Ag+) ��c(NO3-) ��a�������� ��b�������� ����Һ������
A. �� �� B. �� �� C. �� �� �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��S��ClԪ�صĵ��ʼ��������ڹ�ҵ�����е���Ч���ñ��ܹ�ע����ش��������⣺
��1����֪��I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) ��H1��
��.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) ��H2��
HCl(aq)+HClO(aq) ��H2��
��.2HClO(aq) ===2HCl(aq)+O2(g) ��H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) ��H4=____________________(�ú��С�H1����H2�͡�H3�Ĵ���ʽ��ʾ)��
��2��25��ʱ��H2SO3��Һ�и������������ʵ�������(��)����ҺpH�ı仯��ϵ��ͼ����ʾ��
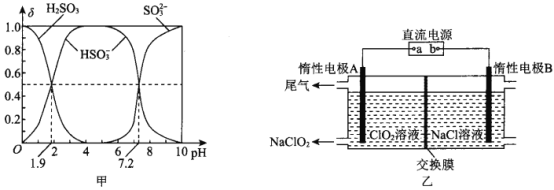
��֪25��ʱ��NaHSO3��ˮ��ҺpH��7����ͼ�е�����ͨ���������ԭ�� ____________________��
��3��NaClO2��һ����ɫ��������Ư������ҵ�ϲ��õ�ⷨ�Ʊ� NaClO2��ԭ����ͼ����ʾ��
�ٽ���ĤӦѡ��____________________(������ӽ���Ĥ���������ӽ���Ĥ��)
�������ĵ缫��ӦʽΪ________________________________________��
��4��һ���¶��£���2L�����ܱ�������ͨ��2molCO��1molSO2��������Ӧ2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ��H=-270kJ/mol������Ӧ���е�20minʱ��ƽ�⣬���CO2���������Ϊ0.5����ǰ20min�ķ�Ӧ����v(CO)= _________�����¶��·�Ӧ��ѧƽ�ⳣ��K=____________��L��mol-1��
S(l)+2CO2(g) ��H=-270kJ/mol������Ӧ���е�20minʱ��ƽ�⣬���CO2���������Ϊ0.5����ǰ20min�ķ�Ӧ����v(CO)= _________�����¶��·�Ӧ��ѧƽ�ⳣ��K=____________��L��mol-1��

��5���ڲ�ͬ�����£���2L�����ܱ�������ͨ��2molCO��1molSO2����Ӧ��ϵ��ѹǿ��ʱ��ı仯��ͼ��I����ʾ��
��ͼ��I��������ʵ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��v(CO)����Ϊ___________������ţ�
����ʵ��a��ȣ�c��ı��ʵ������������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����н�������A������ס��ҡ���������B��C��D��E��F��G������֮���ܷ������·�Ӧ(ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ�����)��

�����������Ϣ�ش��������⣺
��1��ʵ������ȡ�����Ļ�ѧ����ʽΪ4HCl(Ũ)+MnO2![]() Cl2��+MnCl2+2H2O��MnO2��______���������Ӧ�����������ڱ�������Ϊ2.24L����������HCl�����ʵ�����_____mol
Cl2��+MnCl2+2H2O��MnO2��______���������Ӧ�����������ڱ�������Ϊ2.24L����������HCl�����ʵ�����_____mol
��2��д�����з�Ӧ�����ӷ���ʽ��
�ٽ���A��ˮ__________________________________________��
������B��������_______________________________________��
��3����������ѧ����ʽ��ʾ����G��������ϵͳ������ԭ��_______________________��
��4���û�ѧ����ʽ����F���ڷ����ڿ�����ʧЧ��ԭ��___________________________��
��5������ϸ��˿���������Ҿ���ȼ�գ�������____________________����ȼ�ղ�����ɱ�����Һ�����ˮ�п��Եõ��������������壬������������������ֱ����_________֮�䡣���������������е������ϡ���ᣬ������__________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com