
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
(2)写出下列反应的离子方程式:
①金属A和水__________________________________________。
②物质B和气体乙_______________________________________。
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因_______________________。
(4)用化学方程式解释F长期放置在空气中失效的原因___________________________。
(5)红热细铁丝能在气体乙剧烈燃烧,现象是____________________,将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在_________之间。向氢氧化铁胶体中滴入过量稀硫酸,现象是__________________________________。
【答案】 氧化 2 2Na+2H2O=2Na++2OH-+H2↑ 2OH—+Cl2= Cl—+ClO—+H2O 2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH +O2↑ Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑ 产生棕红色的烟 1-100nm 先产生红褐色沉淀最后溶解为黄色溶液
2HCl+O2↑ 产生棕红色的烟 1-100nm 先产生红褐色沉淀最后溶解为黄色溶液
【解析】试题分析:金属A是食盐中的元素,则A是钠,和水反应生成氢氧化钠和氢气,则甲是氢气,B是氢氧化钠。黄绿色气体是氯气,则乙是氯气,和氢气反应生成丙是氯化氢。氯化氢溶于水得到盐酸。浓盐酸和二氧化锰在加热条件下反应生成氯气。氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水。氯气和氢氧化钙反应生成漂白粉,则E是氢氧化钙,F是次氯酸钙。钠和氧气反应生成淡黄色固体是过氧化钠,即G是过氧化钠。
(1)根据方程式4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O可知Mn元素化合价降低,MnO2做氧化剂,如果反应产生的气体在标况下体积为2.24L,即氯气是0.1mol,所以根据氯原子守恒可知被氧化的HCl的物质的量是0.2mol。
Cl2↑+MnCl2+2H2O可知Mn元素化合价降低,MnO2做氧化剂,如果反应产生的气体在标况下体积为2.24L,即氯气是0.1mol,所以根据氯原子守恒可知被氧化的HCl的物质的量是0.2mol。
(2)①金属钠和水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;②氢氧化钠和氯气反应的离子方程式为2OH—+Cl2=Cl—+ClO—+H2O;
(3)过氧化钠能与CO2或水反应生成氧气,可作供氧剂,方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH +O2↑;
(4)次氯酸钙容易吸收空气中的水蒸气和CO2转化为次氯酸,次氯酸易分解,因此长期放置在空气中失效,有关方程式为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO、2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(5)红热细铁丝能在气体氯气剧烈燃烧,现象是产生棕红色的烟。将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在1~100nm之间。向氢氧化铁胶体中滴入过量稀硫酸,首先据此,产生氢氧化铁沉淀,然后是中和,所以实验现象是先产生红褐色沉淀,最后溶解为黄色溶液。


科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过如下反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________(用K1和K2表示)。
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl—N===O):
化学键 | N≡O | Cl—Cl | Cl—N | N===O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
(3)按投料比2∶1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图(a)所示:
①该反应的ΔH________(填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。


(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),在n(NO)/n(Cl2)=1.5时达到平衡状态,ClNO的体积分数可能是图(b)中D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液(废液中杂质沉淀后进入滤液中)的工艺流程如下:
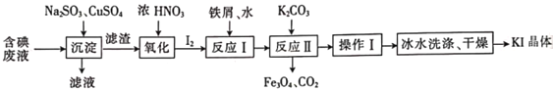
(1)“沉淀”后滤渣为______________________(填化学式,其中滤渣中Cu元素为+1价)
(2)“氧化”反应的离子方程式为______________________。
(3)反应I中只生成化合物FexIy(其中I与Fe的质量比为127︰21),反应中铁屑是___________(填“氧化剂”“还原剂”或“催化剂”,下同),水是___________。反应消耗的铁与转移电子的物质的量之比为___________。
(4)反应Ⅱ的化学方程式为_________________________________。
(5)操作I除蒸发皿、酒精灯外还需用到的玻璃仪器有______________________。冰水洗涤的目的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g) ![]() cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是
cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是

A. T1>T2,Q>0
B. T2>T1,Q>0
C. P1<P2,a+b=c+d
D. P1<P2,b=c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
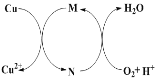
下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中含有的可溶性杂质CaCl2、MgCl2和Na2SO4,需进行下列实验操作,请在( )中填写所使用和除杂试剂的化学式,在![]() 中填写实验操作名称。写出符合下列条件的离子方程式
中填写实验操作名称。写出符合下列条件的离子方程式

(1)①___________ 、 ____________;②_______________________;③____________;④____________;⑤____________;⑥____________;⑦____________。
(2)除去Mg2+的离子方程式_______________________________________________
(3)除去SO42-的离子方程式______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com