
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
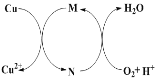
下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
科目:高中化学 来源: 题型:
【题目】C、S和Cl元素的单质及化合物在工业生产中的有效利用备受关注。请回答下列问题:
(1)已知:I.2SO2(g)+O2(g)+2H2O(1) ===2H2SO4(aq) △H1;
Ⅱ.Cl2(g)+H2O(1)![]() HCl(aq)+HClO(aq) △H2;
HCl(aq)+HClO(aq) △H2;
Ⅲ.2HClO(aq) ===2HCl(aq)+O2(g) △H3
SO2(g)+Cl2(g)+2H2 O(1)=2HCl(aq)+H2SO4 (aq) △H4=____________________(用含有△H1、△H2和△H3的代数式表示)。
(2)25℃时,H2SO3溶液中各含硫微粒的物质的量分数(δ)与溶液pH的变化关系如图甲所示。
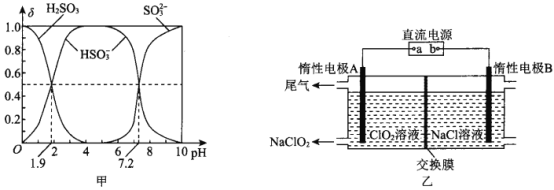
已知25℃时,NaHSO3的水溶液pH<7,用图中的数据通过计算解释原因 ____________________。
(3)NaClO2是一种绿色消毒剂和漂白剂,工业上采用电解法制备 NaClO2的原理如图乙所示。
①交换膜应选用____________________(填“阳离子交换膜”或“阴离子交换膜”)
②阳极的电极反应式为________________________________________。
(4)一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2,发生反应2CO(g)+SO2(g) ![]() S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)
S(l)+2CO2(g) ΔH=-270kJ/mol,若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率v(CO)= _________,该温度下反应化学平衡常数K=____________(L·mol-1)

(5)在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2,反应体系总压强随时间的变化如图(I)所示:
①图(I)中三组实验从反应开始至达到平衡时,v(CO)最大的为___________(填序号)
②与实验a相比,c组改变的实验条件可能是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)实验室制取氯气的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
Cl2↑+MnCl2+2H2O,MnO2做______剂,如果反应产生的气体在标况下体积为2.24L,则被氧化的HCl的物质的量是_____mol
(2)写出下列反应的离子方程式:
①金属A和水__________________________________________。
②物质B和气体乙_______________________________________。
(3)用两个化学方程式表示固体G可做呼吸系统供氧剂原因_______________________。
(4)用化学方程式解释F长期放置在空气中失效的原因___________________________。
(5)红热细铁丝能在气体乙剧烈燃烧,现象是____________________,将燃烧产物配成饱和溶液滴入沸水中可以得到的氢氧化铁胶体,该氢氧化铁胶体粒子直径在_________之间。向氢氧化铁胶体中滴入过量稀硫酸,现象是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将 2 mol 气体A 与 1 mol 气体B 充入一个体积不变的容器内,发生反应:2A+B C+3D+4E,达到平衡后气体A 的浓度减少一半,发现有液体生成,在相同的温度下测得反应 前后压强分别为 6.06×106 Pa 和 8.08×106 Pa,又测得反应共放出热量 Q kJ,下列说法正确的是( )
A. 该反应在任何温度下都可自发进行
B. 在上述平衡体系中再加入 1 mol A 和 0.5 mol B,平衡正向移动,A 的转化率增大
C. 该反应的热化学方程式为 2A(g)+B(g) C(g)+3D(l)+4E(g) ΔH= -Q kJ/mol
D. 上述反应达到平衡后,其他的条件不变的情况下,升高温度,压强一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质在水溶液中的电离方程式正确的是( )
A. NaHSO4 = Na++ HSO4-B. BaSO4 = Ba2++SO42-
C. CH3COONH4![]() NH4+ + CH3COO-D. H2CO3
NH4+ + CH3COO-D. H2CO3![]() 2H++CO32-
2H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2↑+9H2O,下列说法正确的是( )
2HNO3+4N2↑+9H2O,下列说法正确的是( )
A. 分解反应都是氧化还原反应B. N2是还原产物,HNO3是氧化产物
C. 被氧化与被还原的氮原子数之比为3∶5D. 每生成4mol N2转移15mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 含离子键的化合物一定是离子化合物B. 非金属元素只能形成共价化合物
C. 含共价键的化合物一定是共价化合物D. 非极性键只存在于非金属单质中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,11.2L的己烷所含的分子数为0.5NA
B. 28g乙烯所含共用电子对数目为4NA
C. 1mol羟基所含电子数为7 NA
D. 现有乙烯、丙烯的混合气体共14g,其原子数为3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是分离混合物时常用的仪器,回答下列问题:

(1)写出上述仪器的名称
A________, E________。
(2)分离以下混合物应该主要选用上述什么仪器?(填字母符号)
①粗盐和泥沙:________;②花生油和水:______。
(3)关于仪器的使用,下列说法不正确的是________。
A.A仪器可以用酒精灯直接加热
B.B仪器可以用于过滤
C.C仪器在放出液体时应打开上边的塞子
D.在实验室应用D仪器进行实验时要不断用玻璃棒搅拌
E.蒸馏时,E仪器中水的流向是上口进,下口出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com