
【题目】已知:①2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
【答案】B
【解析】
A、燃烧热是指1mol纯物质完全燃烧生成稳定的氧化物所放出的热量;
B、根据反应热和化学方程式系数的关系来回答;
C、中和热是强酸和强碱的稀溶液完全反应生成1mol水时放出的热量,依据概念对选项分析判断;
D、根据盖斯定律计算反应的焓变。
A项、H2(g)的燃烧热ΔH=-285.8 kJ·mol-1,A错误;
B项、根据相关的热化学方程式可以求出氢气和甲醇的热值分别为142.9kJ/g和45.4kJ/g,可知同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出热量多,B正确;
C项、因有BaSO4(s)生成,该反应的ΔH≠-57.3 kJ·mol-1,C错误;
D项、由盖斯定律,1/2×(①×3-②)得3H2(g)+CO2(g)= CH3OH(l)+H2O(l) ΔH=-131.4 kJ·mol-1,D错误。
故选D。


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

则在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________。
(3)已知:N2、O2分子中化学键的键能分别是946kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH= +180.0kJ/mol。NO分子中化学键的键能为__________________kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3(g) ΔH<0。达到平衡,当单独改变下列条件后,有关叙述错误的是
A. 加催化剂v正、v逆都发生变化,而且变化的倍数相等
B. 加压v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C. 降温,v正、v逆都减小,且v正减小的倍数小于v逆减小的倍数
D. 加入氩气,v正、v逆都增大且v正增大的倍数大于v逆增大的倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】)某溶液中含有![]() 、
、![]() 、Cl三种阴离子,如果只取用一次该溶液(可以使用过滤操作),就能把三种离子依次检验出来:
、Cl三种阴离子,如果只取用一次该溶液(可以使用过滤操作),就能把三种离子依次检验出来:
(1)应该先检验_____离子,加入的试剂是稀硝酸,反应的离子方程式为:_____________;
(2)再检验_____离子,加入的试剂是_________,反应的离子方程式为:__________________;
(3)最后检验_____离子,加入的试剂是_________,反应的离子方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式与事实相符且书写正确的是( )
A. 炼铁高炉中生成铁:3C+2Fe2O3![]() 4Fe+3CO2↑
4Fe+3CO2↑
B. 铝放入稀硫酸中:Al+H2SO4=AlSO4+H2↑
C. 向氢氧化钠溶液中加入硫酸铜溶液:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
D. 向小苏打中滴加稀硫酸: Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得诺贝尔化学奖。轮烷是一种分子机器的“轮子”,芳香化合物a、b、c是合成轮烷的三种原料,其结构如下图所示。下列说法不正确的是

A. b、c互为同分异构体
B. a、c分子中所有碳原子均有可能处于同一平面上
C. a、b、c均能发生氧化反应、加成反应、加聚反应和酯化反应
D. a、b、c均能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过如下反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)。
2ClNO(g)。
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=________(用K1和K2表示)。
(2)已知几种化学键的键能数据如下表(亚硝酰氯的结构为Cl—N===O):
化学键 | N≡O | Cl—Cl | Cl—N | N===O |
键能/(kJ·mol-1) | 630 | 243 | a | 607 |
则2NO(g)+Cl2(g) ![]() 2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
2ClNO(g)反应的ΔH和a的关系为ΔH=_______kJ·mol-1。
(3)按投料比2∶1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图(a)所示:
①该反应的ΔH________(填“>”“<”或“=”)0。
②在p压强条件下,M点时容器内NO的体积分数为________。
③若反应一直保持在p压强条件下进行,则M点的分压平衡常数Kp=________(用含p的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。


(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),在n(NO)/n(Cl2)=1.5时达到平衡状态,ClNO的体积分数可能是图(b)中D、E、F三点中的________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
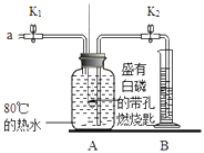
(实验)
①检查装置的气密性,气密性良好。
②向A瓶中加满80℃热水,将盛有白磷的带孔燃烧匙快速浸没热水中,塞紧瓶塞,白磷不燃烧。
③打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。
(1)对比步骤②和③的现象可知,可燃物燃烧的条件之一是___;白磷燃烧的反应方程式为_____。
(2)待装置冷却一段时间后,打开K2,如果观察到____,说明空气中氧气的体积约占1/5。如何确定此装置气密性良好?(忽略燃烧匙位置漏气情况)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液(废液中杂质沉淀后进入滤液中)的工艺流程如下:
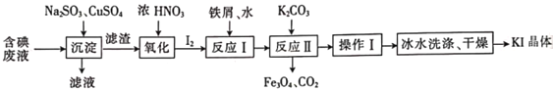
(1)“沉淀”后滤渣为______________________(填化学式,其中滤渣中Cu元素为+1价)
(2)“氧化”反应的离子方程式为______________________。
(3)反应I中只生成化合物FexIy(其中I与Fe的质量比为127︰21),反应中铁屑是___________(填“氧化剂”“还原剂”或“催化剂”,下同),水是___________。反应消耗的铁与转移电子的物质的量之比为___________。
(4)反应Ⅱ的化学方程式为_________________________________。
(5)操作I除蒸发皿、酒精灯外还需用到的玻璃仪器有______________________。冰水洗涤的目的是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com