
【题目】下列化学方程式与事实相符且书写正确的是( )
A. 炼铁高炉中生成铁:3C+2Fe2O3![]() 4Fe+3CO2↑
4Fe+3CO2↑
B. 铝放入稀硫酸中:Al+H2SO4=AlSO4+H2↑
C. 向氢氧化钠溶液中加入硫酸铜溶液:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
D. 向小苏打中滴加稀硫酸: Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是
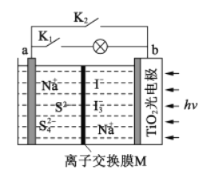
A. 充电时,太阳能转化为化学能,化学能又转化为电能
B. 放电时,a极为正极
C. 充电时,阳极的电极反应式为3I--2e-=I3-
D. M可以使用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
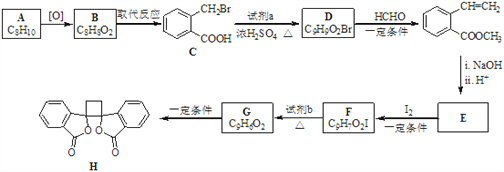
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()

(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成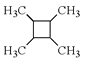 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1 L恒容密闭容器中加入1 mol的N2(g)和3 mol H2(g)发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )
2NH3(g) ΔH<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )
时间/min | 0 | t1 | t2 | t3 |
NH3物质的量/mol | 0 | 0.2 | 0.3 | 0.3 |
A. 0~t1 min,v(NH3)=0.2/t1 mol·L-1·min-1
B. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆向移动
C. N2(g)+3H2(g)![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g)![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. t3 min时再加入1 mol的N2(g)和3 mol H2(g),反应达到新平衡时,c(N2)>0.85 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物中一定含离子键
B.离子化合物不可能只由非金属元素组成
C.离子化合物均能溶于水
D.熔化状态下能导电的物质一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
③H+(aq)+OH-(aq)![]() H2O(l) ΔH=-57.3 kJ·mol-1
H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A. H2(g)的燃烧热为142.9 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. 1/2H2SO4(aq)+1/2Ba(OH)2(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)![]() CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )

A. 甲物质的溶解度比乙物质的溶解度大
B. 加入试管1的固体是丙
C. 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D. 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲=丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示( )
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ① ③ B. ③ ④ C. ① ② ④ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验是化学学习中非常重要的内容,根据下面两个实验回答问题。
(一)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/L NaOH溶液,制得等量Mg(OH)2沉淀。
(1)分别向两支试管中加入不同试剂,记录实验现象如表:(表中填空填下列选项中字母代号)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | ①_____ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | ②_____ |
A.白色沉淀转化为红褐色沉淀 B.白色沉淀不发生改变
C.红褐色沉淀转化为白色沉淀 D.白色沉淀溶解,得无色溶液
(2)同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的溶解平衡正向移动。
猜想2:____________________________________________________________。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明猜想正确的是____(填 “1”或“2”)。
(二)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量。准确称取5.000 0 g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI===3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250 mL,然后取25.00 mL用5.0×10-4 mol·L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+2S2O32-===2I-+S4O62-)。有关实验数值如下表所示。
滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
第一次 | 25.00 | 0.00 | 15.90 |
第二次 | 25.00 | 0.00 | 14.99 |
第三次 | 25.00 | 0.00 | 15.01 |
该碘盐中碘元素的百分含量为________。(保留三位有效数字)下列操作中,会导致所测得的碘元素的百分含量偏大的是________。
a.滴定终时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com