
【题目】下列有关四个常用的电化学装置的叙述,正确的是( )
A.图 所示碱性锌锰电池中,MnO2是催化剂
所示碱性锌锰电池中,MnO2是催化剂
B.图 所示铅蓄电池放电过程中,硫酸浓度保持不变
所示铅蓄电池放电过程中,硫酸浓度保持不变
C.图 所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度不断增大
所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度不断增大
D.图 所示纽扣式锌银电池工作过程中,外电路中电子由锌极流向氧化银极
所示纽扣式锌银电池工作过程中,外电路中电子由锌极流向氧化银极
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小的顺序为__________.
(2)B为0.1mol·L-1 NaHCO3溶液,请分析NaHCO3溶液显碱性的原因__________.
(3)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),
Ag+(aq)+Cl-(aq),
在25 ℃时,氯化银的Ksp=1.8×10-10。现将足量氯化银分别放入:
①100 mL 蒸馏水中; ②100 mL 0.2 mol·L-1 AgNO3溶液中;
③100 mL 0.1 mol·L-1氯化铝溶液中; ④100 mL 0.1 mol·L-1盐酸溶液中,
充分搅拌后,相同温度下银离子浓度由大到小的顺序是________(填写序号);②中氯离子的浓度为______ mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,向2m g 16%的CuSO4溶液中加入m g CuSO45H2O,溶液恰好达到饱和,该饱和溶液中CuSO4的质量分数为_____。
(2)标准状况下,1体积水可溶解V体积HCl气体,所得溶液的密度为ρg/cm3,则所得溶液溶质的质量分数表示为_____,溶质的物质的量浓度表示为_____。
(3)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1硫酸溶液的溶质的质量分数,且知 2a=b,则下列推断正确的是(硫酸溶液的密度比纯水的大)_____(填序号)
A. 2ω1=ω2 B. ω2<2ω1 C. ω2>2ω1 D. ω1<ω2<2ω1
(4)若以ω1和ω2分别表示浓度为a molL﹣1和b molL﹣1氨水的溶质的质量分数,且知2ω1=ω2,则下列推断正确的是(氨水的密度比纯水的小)_____(填序号)
A. 2a=b B. 2a<b C. 2a>b D. a<b<2a.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
2NO+O2在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间生成n mol O2,同时生成2n mool NO ②单位时间内生成n mol O2,同时生成2n mol NO2 ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1 ④混合气体的颜色不再改变 ⑤混合气体的密度不再改变 ⑥混合气体的平均相对分子质量不再改变
A. ①③⑤ B. ②④⑥ C. ②③④ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在稀溶液里,强酸跟强碱发生中和反应生成1 mol液态水时反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:

(1)图中未画出的实验器材是________________、________________。
(2)做一次完整的中和热测定实验,温度计需使用________次。
(3)实验时,将0.50 mol·L-1的盐酸加入到0.55mol·L-1的NaOH溶液中,两种溶液的体积均为50 mL,各溶液的密度均为1 g /cm3,生成溶液的比热容c=4.18 J /(g· oC),实验的起始温度为t1 oC,终止温度为t2 oC。测得温度变化数据如下:
序号 | 反应物 | 起始温度t1/ oC | 终止温度t2/ oC | 中和热 |
① | HCl+NaOH | 14.8 | 18.3 | ΔH1 |
② | HCl+NaOH | 15.1 | 19.7 | ΔH1 |
③ | HCl+NaOH | 15.2 | 18.5 | ΔH1 |
④ | HCl+NH3·H2O | 15.0 | 18.1 | ΔH2 |
①试计算上述两组实验测出的中和热ΔH1=______________。
②某小组同学为探究强酸与弱碱的稀溶液反应时的能量变化,又多做了一组实验④,用0.55mol·L-1的稀氨水代替NaOH溶液,测得温度的变化如表中所列,试计算反应的ΔH2=____________。
③两组实验结果差异的原因是___________________________________________。
④写出HCl+NH3· H2O反应的热化学方程式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(Na2Cr2O7·2H2O)是重要的化工原料,工业上用铬铁矿(主要成分是FeO·Cr2O3)制备红矾钠的过程中会发生如下反应:
4FeO(s)+4Cr2O3(s)+8Na2CO3(s)+7O2(g) ![]() 8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
8Na2CrO4(s)+2Fe2O3(s)+8CO2(g) ΔH<0
(1)如图为上述反应的浓度—时间图像,由图像判断反应进行至t2时刻时,改变的条件是_________________________,如图为上述反应的速率—时间图像,表示上述反应在t1时达到平衡, 在t2时因改变某个条件而使曲线发生变化。由图判断,t2时刻曲线变化的原因可能是________(填写序号)。
a.升高温度 b.加催化剂
c.通入O2 d.缩小容器体积

(2)工业上可利用上述反应的副产物CO2来生产甲醇:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
①一定温度下,在容积为1L的密闭容器中,充入2 mol CO2和4 mol H2,一段时间后达到平衡,测得CH3OH的物质的量浓度为1mol/L,则该温度下此反应的平衡常数为_________,某时刻测得CO2、H2、CH3OH和H2O的物质的量分别为2mol,1mol,1mol,1mol,则这一时刻v(正)___________v(逆)
②在T1温度时,将1 mol CO2和3 mol H2充入一密闭容器中,充分反应达到平衡后,CO2转化率为α,则容器内的压强与起始压强之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型水系钠离子电池工作原理如下图所示。TiO2光电极能使电池在太阳光照下充电,充电时 Na2S4转化为 Na2S。下列说法正确的是
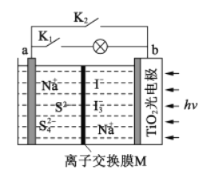
A. 充电时,太阳能转化为化学能,化学能又转化为电能
B. 放电时,a极为正极
C. 充电时,阳极的电极反应式为3I--2e-=I3-
D. M可以使用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:
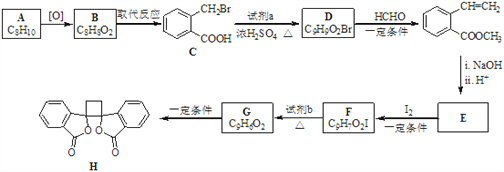
已知:i.RCH2Br ![]() R﹣HC═CH﹣R′
R﹣HC═CH﹣R′
ii.R﹣HC═CH﹣R′![]()
![]()
iii.R﹣HC═CH﹣R′![]()

(以上R、R'、R'代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是_______________________。
(2)D的结构简式是_______________________________。
(3)由F生成G的反应类型是________________________________________。
(4)由E与I2在一定条件下反应生成F的化学方程式是_____________________;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_______________________________。
(5)下列说法正确的是___________(选填字母序号)。
A. G存在顺反异构体
B. 由G生成H的反应是加成反应
C. 1 mol G最多可以与1 mol H2发生加成反应
D. 1 mol F或1 mol H与足量NaOH溶液反应,均消耗2 molNaOH
(6)以乙烯为起始原料,结合已知信息选用必要的无机试剂合成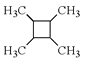 写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com