
【题目】为除去粗盐中的Ca2+、Mg2+、SO![]() 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液![]()
![]() 精盐
精盐
(1)第①步中,操作A是________,第⑤步中,操作B是________。
(2)第④步中,写出相应的化学方程式(假设粗盐溶液中Ca2+的主要存在形式为CaCl2)_______。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是__________________。
(4)判断BaCl2已过量的方法是___________________________________。
【答案】溶解过滤CaCl2+Na2CO3===CaCO3↓+2NaCl BaCl2+Na2CO3===BaCO3↓+2NaCl操作③④中生成的Mg(OH)2、CaCO3、BaCO3沉淀会与盐酸反应生成可溶物质而无法过滤除去,从而影响精盐的纯度取少量第②步后的上层清液,滴入几滴BaCl2溶液,看是否有白色沉淀生成,若无沉淀生成,则表明BaCl2已过量。
【解析】
(1)粗盐提纯须先加水溶解,再加入试剂BaCl2、NaOH、Na2CO3除去可溶性的![]() 、Mg2+、Ca2+,过滤后,加入盐酸除去过量的NaOH、Na2CO3,最后蒸发、结晶得到精盐,操作A为溶解,操作B为过滤;(2)Na2CO3的作用是除去溶质中Ca2+以及过量的Ba2+,因此反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;(3)若先用盐酸调pH再过滤,将使产生的Mg(OH)2、CaCO3、BaCO3沉淀溶解而无法过滤除去,影响精盐的纯度;(4)BaCl2过量时,不存在
、Mg2+、Ca2+,过滤后,加入盐酸除去过量的NaOH、Na2CO3,最后蒸发、结晶得到精盐,操作A为溶解,操作B为过滤;(2)Na2CO3的作用是除去溶质中Ca2+以及过量的Ba2+,因此反应方程式为CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl;(3)若先用盐酸调pH再过滤,将使产生的Mg(OH)2、CaCO3、BaCO3沉淀溶解而无法过滤除去,影响精盐的纯度;(4)BaCl2过量时,不存在![]() ,故再滴入几滴BaCl2溶液,看是否有白色沉淀生成,即可判断BaCl2是否过量。
,故再滴入几滴BaCl2溶液,看是否有白色沉淀生成,即可判断BaCl2是否过量。


科目:高中化学 来源: 题型:
【题目】铜、镁、金等的相关物质在生产生活中具有重要的作用。回答下列问题:
(1)铜元素在周期表中的位置是___________,基态铜原子中,核外电子占据最高能层的符号是___________,占据该最高能层的电子数为___________。
(2)在一定条件下,金属相互化合形成的化合物称为金属互化物,如Cu9Al4、 Cu5Zn8等。某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于___________(填“晶体”或“非晶体”)
(3)铜能与类卤素[(SCN)2]反应生成Cu(SCN)2,lmol(SCN)2分子中含有σ键的数目为___________。(SCN)2对应的酸有硫氰酸(H-S-C≡N)、异硫氰酸(H-N=C=S)两种。理论上前者沸点低于后者,其原因是____________________________________________。
(4)铜与金形成的金属互化物的晶胞结构如图1所示,其晶胞边长为anm,该金属互化物的密度为___________(用含a、NA的代数式表示)g·cm-3。

(6)某金属晶体中原子的堆积方式为六方最密堆积如图2所示,晶胞可用图3表示。已知该金属的原子半径为acm,该金属晶胞的高为bcm:若以晶胞中A点原子为原点建立空间直角坐标系o-xyz,则A点原子的坐标为(0,0,0),C点原子的坐标为(2a,0,0),D点原子的坐标为(0,0,b),则B点原子的坐标为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯: ,下列说法正确的是
,下列说法正确的是
A. 该反应的类型为消去反应
B. 乙苯的同分异构体共有三种
C. 可用Br2/CCl4鉴别乙苯和苯乙烯
D. 乙苯和苯乙烯分子内共平面的碳原子数均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200ml含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是

A. x-y=0.01mol B. 原溶液中c(Cl-)=0.75mol·L-1
C. 原溶液的pH=1 D. 原溶液中n(Mg2+):n(Al3+)=5:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
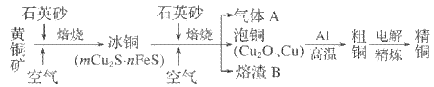
A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式____________
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式________________________ 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1_________P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)___________v(逆)(填“大于”、“小于”或“等于”)。

(4)以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。
②为了提高该反应中CH4的转化率,可以采取的措施是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某同学设计如图所示装置探究氯气能否与水发生反应。气体a的主要成分是含有少量水蒸气的氯气。请回答下列问题:


(1)气体a由右图甲或乙制备 ,若选用图中的甲装置,反应的离子方程式是_____,若选用装置乙,其中的导管 a 的作用是_____。
(2)证明氯气和水发生反应的实验现象为_____________。
(3)该实验设计存在缺陷,为了克服该缺陷,需要补充装置D,其中发生反应的离子方程式为_________________。
II.如图为浓硫酸与铜反应及其产物检验的实验装置

回答下列问题:
(1)指出试管c中产生的实验现象:______________________。
(2) 用可抽动的铜丝代替铜片的优点___________。
(3)写出浓硫酸与铜反应的化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关四个常用的电化学装置的叙述,正确的是( )
A.图 所示碱性锌锰电池中,MnO2是催化剂
所示碱性锌锰电池中,MnO2是催化剂
B.图 所示铅蓄电池放电过程中,硫酸浓度保持不变
所示铅蓄电池放电过程中,硫酸浓度保持不变
C.图 所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度不断增大
所示电解精炼铜装置工作过程中,电解质溶液中Cu2+浓度不断增大
D.图 所示纽扣式锌银电池工作过程中,外电路中电子由锌极流向氧化银极
所示纽扣式锌银电池工作过程中,外电路中电子由锌极流向氧化银极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com