
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
【答案】C
【解析】
A.根据化学反应速率的定义可知,利用单位时间内浓度的变化量来计算化学反应速率;
B.利用一定条件下反应前后的物质的量之比等于压强之比来计算;
C.利用平衡时容器内压强为开始时的1.6倍来计算平衡时各物质的物质的量;
D.若往容器内充入N2O4气体,相当于压缩容器体积,相当于增大压强,利用压强对化学平衡的影响来分析能否提高N2O4的转化率。
A项,前2秒,以NO2的浓度变化表示的平均反应速率为![]() =0.01mol/(L·s)
=0.01mol/(L·s)
,则以N2O4浓度变化表示的平均反应速率为0.005mol/(L·s),故A项错误;
B项2秒时,NO2的浓度为0.02 mol/L,其物质的量为0.02 mol/L×5L=0.1mol,则容器内气体的总物质的量为0.5mol-0.05mol+0.1mol=0.55mol,容器内的压强为反应前的![]() =1.1倍,故B项错误;
=1.1倍,故B项错误;
C项,平衡时,体系内的总物质的量为0.5mol×1.6=0.8mol,设剩余N2O4的物质的量为xmol,则有(0.5-x)×2+x=0.8,解得x=0.2mol,即体系内含0.2molN2O4,故C项正确;
D项,平衡时,若往容器内充入N2O4气体,相当于在原来的基础上缩小体积,由N2O4═2NO2,则缩小体积,压强增大,化学平衡逆向移动,N2O4的转化率降低,故D项错误。
综上所述,本题正确答案为C。


科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为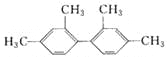 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中至少有9个碳原子处于同一平面上
B. 分子中至少有11个碳原子处于同一平面上
C. 分子中至少有16个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )
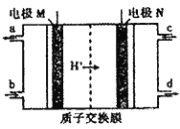
A. M极生成氮气且电极附近溶液酸性增强
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g)。现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。下列说法错误的是
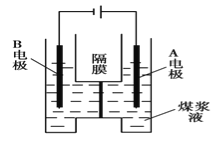
A. A极是阳极,B极为阴极
B. A极的电极反应式为C+2H2O-4e-=CO2↑+4H+
C. B极的电极反应式为2H++2e-=H2↑
D. 电解一段时间后,煤浆液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,试写出该腐蚀过程中的电极反应式:负极________;正极________。
(2)为了减缓某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填序号)。
A.铜 B.钠
C.锌 D.石墨
(3)图乙所示的方案也可以减缓铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
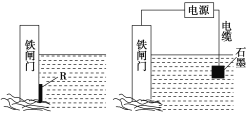
图甲 图乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是________。
①C(CH3)4和C4H10
②![]() 和
和![]()
③35Cl和37Cl
④![]() H2O和
H2O和![]() H2O
H2O
⑤石墨和金刚石
⑥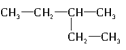 和
和![]()
⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导滴定是利用溶液的电导改变以确定滴定终点的滴定方法。常温下,将0.10mol·L-1CH2COOH溶液与0.10mo1·L-1HCl溶液以一定体积比混合,用0.10mol·L-1NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是

A. a点溶液的pH=1
B. b点溶液中:c(Na+)=c(Clˉ)+c(CH3COOˉ)
C. 图中四点,C点处溶液中水的电离度最大
D. d点溶液中:c(Na+)>c(Clˉ)>c(CH3COOˉ)>c(OHˉ)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. 己二酸电离常数Ka1(H2X)约为10-4.4
B. 曲线M表示pH与![]() 的变化关系
的变化关系
C. 当溶液中c(X2—)=c(HX—)时,溶液为碱性
D. 当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
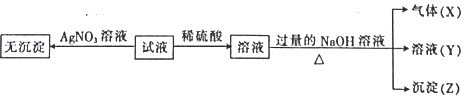
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com