
【题目】用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g)。现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。下列说法错误的是
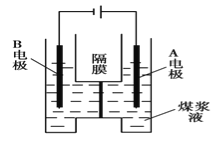
A. A极是阳极,B极为阴极
B. A极的电极反应式为C+2H2O-4e-=CO2↑+4H+
C. B极的电极反应式为2H++2e-=H2↑
D. 电解一段时间后,煤浆液的pH增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中存在一些守恒或平衡原理,下列叙述正确的是
A. 根据质量(原子)守恒定律,某物质完全燃烧的产物是CO2和H2O则该物质一定是烃
B. 根据能量守恒定律,所有化学反应的反应物的总能量一定等于生成物的总能量
C. 根据电子守恒定律,原电池中负极反应失电子数一定等于正极反应得电子数
D. 根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O![]() Cu2O+H2↑。下列说法正确的是
Cu2O+H2↑。下列说法正确的是
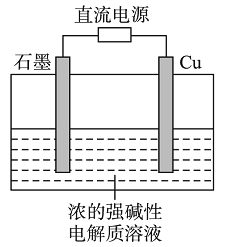
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有0.1mol/L Na2SO4溶液300mL,0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是( )
A.1︰1︰1B.3︰2︰1C.3︰2︰3D.1︰1︰3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:
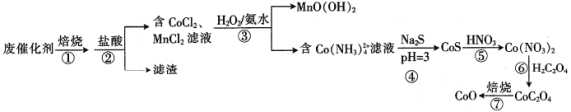
回答下列问题:
(1)步骤①焙烧的目的是_________________________________。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________(填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com