
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。
【答案】92 该反应是可逆反应,1 mol氮气和3 mol 氢气不能完全反应,放出的能量总是小于92 kJ 0.25 50% cf 正向 减小
【解析】
(1)△H=反应物键能和-生成物键能和,反应N2+3H2![]() 2NH3的△H=(946+3×436-6×391)kJ/mol=-92kJ/mol;
2NH3的△H=(946+3×436-6×391)kJ/mol=-92kJ/mol;
(2)合成氨为可逆反应,反应物不能完全转化为生成物;
(3)结合υ=![]() ,转化率=
,转化率=![]() ×100%计算;
×100%计算;
(4)平衡时正逆反应速率相等,浓度不变,为动态平衡,为反应的最大限度;
(5)根据反应特点,结合化学反应速率影响因素及平衡移动原理分析。
(1)△H=反应物键能和-生成物键能和,反应N2+3H2![]() 2NH3的△H=(946+3×436-6×391)kJ/mol=-92kJ/mol;
2NH3的△H=(946+3×436-6×391)kJ/mol=-92kJ/mol;
(2)将1 mol N2和3 mol H2混合,使充分反应,反应放出的热量总小于上述数值,是因为合成氨为可逆反应,反应物不能完全转化为生成物NH3,所以1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于92kJ;
(3)在恒温恒容时,气体的压强比等于气体的物质的量的比,开始时气体的物质的量为2mol+3mol=5mol,由于平衡时气体压强为原来的80%,则气体的物质的量减小5mol-5mol×80%=1mol。根据方程式N2+3H2![]() 2NH3可知:每有1molN2反应,反应后会减小2mol,现在气体的物质的量减小1mol,则反应的N2的物质的量为0.5mol,所以用氮气表示的化学反应速率是υ(N2)=
2NH3可知:每有1molN2反应,反应后会减小2mol,现在气体的物质的量减小1mol,则反应的N2的物质的量为0.5mol,所以用氮气表示的化学反应速率是υ(N2)=![]() =
=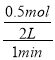 =0.25mol/(L·min);根据方程式可知N2、H2反应的物质的量的比是1:3,氮气反应了0.5mol,则氢气反应了1.5mol,由于反应开始时加入氢气的物质的量为3mol,所以氢气的转化率为=
=0.25mol/(L·min);根据方程式可知N2、H2反应的物质的量的比是1:3,氮气反应了0.5mol,则氢气反应了1.5mol,由于反应开始时加入氢气的物质的量为3mol,所以氢气的转化率为=![]() ×100%=50%;
×100%=50%;
(4) a.化学平衡为动态平衡,达到平衡时正反应速率和逆反应速率相等但不为零,a错误;
b.反应达到平衡时,氮气和氢气的转化率可能相等,也可能不相等,这与反应开始时加入的两种物质的物质的量多少有关,b错误;
c.反应从正反应方向开始,若氮气的转化率达到最大值,则反应达到平衡,c正确;
d.达到平衡时氮气和氢气的浓度不一定相等,这与起始量、物质的转化率有关,d错误;
e.N2、H2和NH3的体积分数相等,反应可能处于平衡状态,也可能未处于平衡状态,e错误;
f.反应达到最大程度,任何物质的浓度不再发生变化,反应达到平衡状态,f正确;
故合理选项是cf;
(5)生产过程中通常将氨气及时分离出去,则c(NH3)减小,根据平衡移动原理:减小生成物浓度,化学平衡向正向移动,由于物质的浓度降低,所以正反应速率将减小。


科目:高中化学 来源: 题型:
【题目】有机物A~H的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
请回答下列问题:
(1)E的官能团名称为____________。反应③的反应类型__________________________。
(2)关于有机物A、B、C、D的下列说法,正确的是___________________(选填序号)。
a.B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
b.B的同系物中,当碳原子数≥5时开始出现同分异构现象
c.等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
(3)写出下列反应的化学方程式:
反应④:_________________________________。反应⑤:_____________________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:________,并说明理由:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
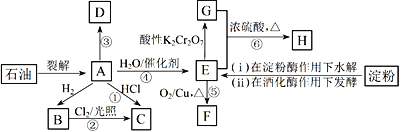
【题目】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
(制备NaClO溶液)
实验装置如图甲所示部分夹持装置已省略
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________。
(3)装置I中发生的化学反应方程式是 ____________________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________。
(制取水合肼)
实验装置如图乙所示。
(4)仪器B的名称为_________;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式_________________。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为_____________________________________。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、脂肪和蛋白质的叙述正确的是( )
A.糖类都能表示为Cm(H2O)n
B.糖类和脂肪都是储能物质
C.脂肪由脂肪酸和甘油构成,所以脂肪是一种高分子化合物
D.糖类、脂肪和蛋白质都能氧化分解释放能量供给生物利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )
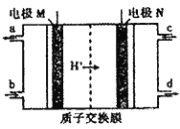
A. M极生成氮气且电极附近溶液酸性增强
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
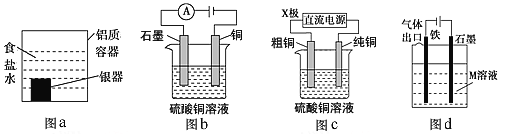
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g)。现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。下列说法错误的是
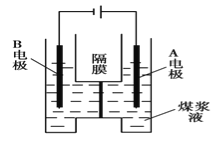
A. A极是阳极,B极为阴极
B. A极的电极反应式为C+2H2O-4e-=CO2↑+4H+
C. B极的电极反应式为2H++2e-=H2↑
D. 电解一段时间后,煤浆液的pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中
(1)互为同分异构体的是________,
(2)互为同素异形体的是________,
(3)互为同位素的是________,
(4)属于同一物质的是________。
①C(CH3)4和C4H10
②![]() 和
和![]()
③35Cl和37Cl
④![]() H2O和
H2O和![]() H2O
H2O
⑤石墨和金刚石
⑥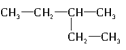 和
和![]()
⑦(CH3)2CHCH(CH3)2 和(CH3)2CH(CH2)2CH3
⑧H2 D2 T2
⑨CH2=CH-CH2CH3和CH3-CH=CH-CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
则x=___________。
化学键 | H-H | C-O | C三O | H-O | C-H |
E/(kJmol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
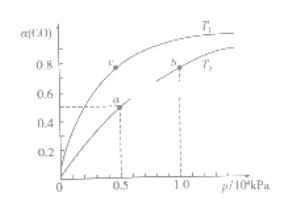
①T1_________T2(填“>”、“<”、“=”);a、b两点的反应速率:v(a)_____v(b)(填“>”、“<”、“=”);
在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_____(填字母);
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
②计算图中a点的平衡常数KP=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
a:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
b:CO2(g)+H2(g)![]() CO(g)+H2O(g) H2
CO(g)+H2O(g) H2
c:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
①述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
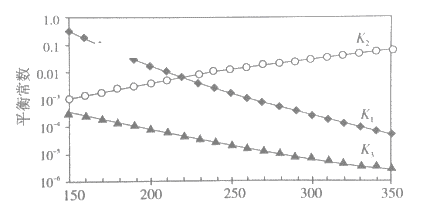
则H1__________H3(填“>”、“<”、“=”),理由是_______。
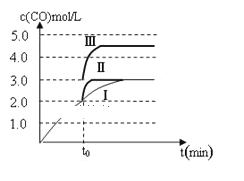
②一定温度下,在3 L容积可变的密闭容器中发生反应b,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________。
③反应c的 △H___0, △S____0(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com