
【题目】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
(制备NaClO溶液)
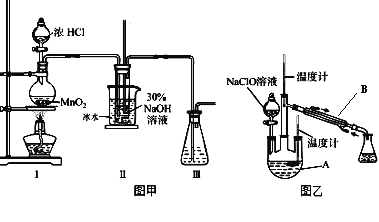
实验装置如图甲所示部分夹持装置已省略
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________。
(3)装置I中发生的化学反应方程式是 ____________________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________。
(制取水合肼)
实验装置如图乙所示。
(4)仪器B的名称为_________;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式_________________。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为_____________________________________。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______。
【答案】![]() 烧杯、玻璃棒 MnO2+4HCl(浓)
烧杯、玻璃棒 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 防止温度过高次氯酸钠变为氯化钠和氯酸钠 直形冷凝管 N2H4·H2O+2NaClO====2NaCl+N2↑+3H2O 冷却后补加 滴定终点时的现象为当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失。 30.0%
MnCl2+Cl2↑+2H2O 防止温度过高次氯酸钠变为氯化钠和氯酸钠 直形冷凝管 N2H4·H2O+2NaClO====2NaCl+N2↑+3H2O 冷却后补加 滴定终点时的现象为当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失。 30.0%
【解析】
(1)肼是共价化合物,原子之间通过共价键结合,则肼的电子式为:![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(2)配制30%的NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒。本小题答案为:烧杯、玻璃棒。
(3)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,化学反应方程式为:![]() 。温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以步骤Ⅰ温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠。本小题答案为:
。温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以步骤Ⅰ温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠。本小题答案为:![]() ;防止温度过高次氯酸钠变为氯化钠和氯酸钠。
;防止温度过高次氯酸钠变为氯化钠和氯酸钠。
(4)仪器B为直形冷凝管。![]() 具有强还原性,容易被过量的NaClO氧化,发生的反应为:
具有强还原性,容易被过量的NaClO氧化,发生的反应为:![]() 。本小题答案为:直形冷凝管;
。本小题答案为:直形冷凝管;![]() 。
。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是冷却后补加。碘的标准溶液与肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失。
设馏分中水合肼的质量分数为α,则
N2H4·H2O + 2I2==N2↑+4HI+H2O
1mol 2mol
![]()
![]()
计算得出α=30.0%
本小题答案为:冷却后补加;滴定终点时的现象为当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失;30.0%。


科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是( )

A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收多余的SO2,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浓硫酸与木炭粉在加热条件下的化学方程式为________。
(2)已知酸性KMnO4溶液可以吸收SO2,试用下图所示各装置设计一个实验,验证上述反应所产生的各种产物。这些装置的连接顺序(按产物气流从左到右的方向)是:___→___→___→___。(填装置的编号)
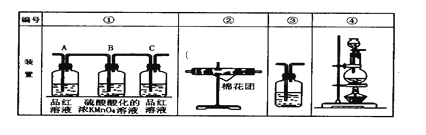
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色。A瓶溶液的作用是______,C瓶溶液的作用是______。
(4)装置②中所加的固体药品是______,装置③中所盛溶液是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在____(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在____(高温,低温,任何温度)下可自发进行
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_____________。
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_____________。
A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. ![]() (SO2):
(SO2):![]() (O2):
(O2):![]() (SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
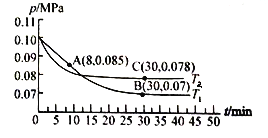
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率![]() 0(正)与A点的逆反应速率
0(正)与A点的逆反应速率![]() A(逆)的大小关系为
A(逆)的大小关系为![]() 0(正)_____
0(正)_____![]() A(逆) (填“>"、“<”或“ = ”)。
A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A. 0.21 mol
B. 0.25 mol
C. 0.3 mol
D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中存在一些守恒或平衡原理,下列叙述正确的是
A. 根据质量(原子)守恒定律,某物质完全燃烧的产物是CO2和H2O则该物质一定是烃
B. 根据能量守恒定律,所有化学反应的反应物的总能量一定等于生成物的总能量
C. 根据电子守恒定律,原电池中负极反应失电子数一定等于正极反应得电子数
D. 根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:
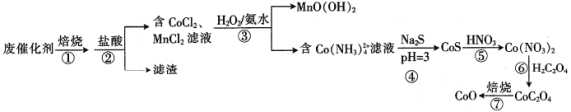
回答下列问题:
(1)步骤①焙烧的目的是_________________________________。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________(填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com