
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
则x=___________。
化学键 | H-H | C-O | C三O | H-O | C-H |
E/(kJmol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
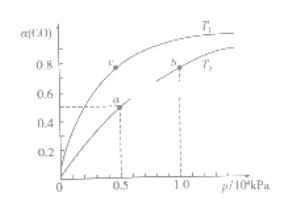
①T1_________T2(填“>”、“<”、“=”);a、b两点的反应速率:v(a)_____v(b)(填“>”、“<”、“=”);
在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_____(填字母);
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
②计算图中a点的平衡常数KP=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
a:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
b:CO2(g)+H2(g)![]() CO(g)+H2O(g) H2
CO(g)+H2O(g) H2
c:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
①述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
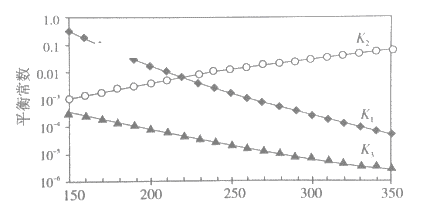
则H1__________H3(填“>”、“<”、“=”),理由是_______。
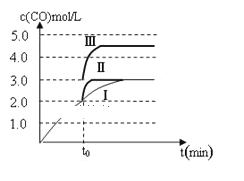
②一定温度下,在3 L容积可变的密闭容器中发生反应b,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________。
③反应c的 △H___0, △S____0(填“>”“=”或“<”)。
【答案】1076<<bc1.6×10-7 (kPa)-2<由图可知,随着温度升高,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3加入催化剂将容器的体积快速压缩至2L<<
【解析】
(1)根据反应热=反应物的总键能-生成物的总键能计算;
(2)①压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故T1<T2;压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);根据化学平衡时正逆反应速率相等,各物质含量不再改变分析;
②结合化学平衡三行计算列式计算平衡物质的物质的量,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;
(3) ①反应1、2、3其对应的平衡常数分别为K1、K2、K3,根据图1它们随温度变化的曲线结合盖斯定律进行分析解答。
②图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大,反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变;
③由图可知,随着温度升高,K3减小,则△H3<0,根据反应物和产物气体系数和的大小可以判断熵变符号。
(1)反应热=反应物的总键能-生成物的总键能,则△H =2×436+x-343-413×3-465=-99,计算得出x=1076;
因此,本题正确答案是:1076;
(2)①压强相同时一氧化碳的转化率高,所以平衡正向移动,而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故T1<T2;压强越大反应速率越快,所以a、b两点的反应速率:v(a)<v(b);
a.H2的消耗速率是CH3OH生成速率的2倍均为正反应速率,不能说正逆反应速率相等,故a错误;
b.CH3OH的体积分数随着反应的进行增大,不再改变时化学平衡,故b正确;
c.混合气体的总质量不变,容器可变,则混合气体的体积减小,密度增大,不再改变时化学平衡,故c正确;
d.CO和CH3OH的物质的量之和保持不变,不能说明化学平衡,故d错误;
因此,本题正确答案是:< ;<;bc
②a点的一氧化碳转化率为50%,总压为0.5![]() 104pa,
104pa,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol) 1 2 0
变化量(mol) x 2x x
平衡量(mol) 1-x 2-2x x
而一氧化碳转化率为50%,所以x=0.5,Kp= =1.6×10-7 (kPa)-2;
=1.6×10-7 (kPa)-2;
因此,本题正确答案是:1.6×10-7 (kPa)-2;
(3) ①由图可以知道,随着温度升高,K2减小,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3 ;
因此,本题正确答案是:< ;由图可知,随着温度升高,K2增大,则△H2>0,根据盖斯定律又得△H3=△H1+△H2,所以△H1<△H3;
②图象分析曲线Ⅰ变化为曲线Ⅱ是缩短反应达到平衡的时间,最后达到相同平衡状态,体积是可变得是恒压容器,说明改变的是加入了催化剂;当曲线Ⅰ变为曲线Ⅲ时一氧化碳物质的量增大反应是气体体积不变的反应,可变容器中气体体积和浓度成反比,气体物质的量不变,曲线Ⅰ,体积为3L,一氧化碳浓度为3mol/L,改变条件不好为曲线Ⅱ,一氧化碳浓度为4.5mol/L,则体积压缩体积为:3:V=4.5:3,V=2L,所以将容器的体积快速压缩至2L符合;
因此,本题正确答案是:加入催化剂;将容器的体积快速压缩至2L;
③由图可知,随着温度升高,K3减小,则△H3<0;该反应中,反应物的系数和大于产物气体系数和,所以该反应是熵减的反应,熵变小于零,
因此,本题正确答案是:<;<。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H—H键、1 mol N—H键、1 mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol氮气完全反应生成氨气可放出的能量为__________ kJ。
(2)如果将1 mol氮气和3 mol氢气混合,使其充分反应,反应放出的能量总小于上述数值,为什么?_______________。
(3)实验室模拟工业合成氨时,在容积为2 L的密闭容器内,充入2 mol氮气和3 mol氢气反应经过1分钟后,达到平衡状态,此时容器内压强为原来的80%,则用氮气表示的化学反应速率是________ mol/(L·min),氢气的转化率为________。
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是________。
a.正反应速率和逆反应速率相等且为零 b.氮气和氢气的转化率相等
c.氮气的转化率达到最大值 d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等 f.反应达到最大程度
(5)生产过程中通常将氨气及时分离出去,则平衡________(填正向,逆向,不)移动,正反应速率将________(增大,减小,不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:
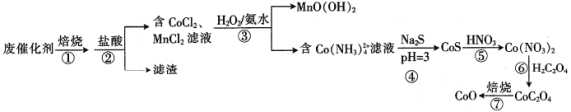
回答下列问题:
(1)步骤①焙烧的目的是_________________________________。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________(填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲将0.10 mol·L-1的NaOH溶液和0.60 mol·L-1的NaOH溶液混合成0.20 mol·L-1的NaOH溶液。求两种溶液的体积比(忽略混合时体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
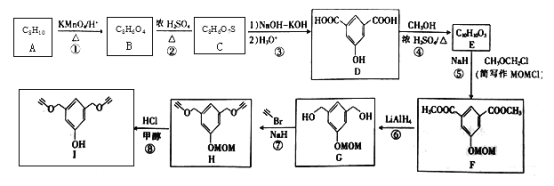
【题目】化合物I可用于某种高分子的接枝,其一种合成路线如下:
回答下列问题:
(1)A的化学名称是_______________________。
(2)②的反应类型是______________________。
(3)C的结构简式为_________________;H的分子式为__________________。
(4)F中含氧官能团的名称是___________。
(5)芳香化合物W是E的同分异构体,W能发生水解反应和银镜反应,核磁共振氢谱有四组峰,面积比为1︰1︰2︰6,写出一种符合要求的W的结构简式:___________。
(6)尼泊金丙酯(HO-![]() -COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
-COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。
CH3OH(g) ΔH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如下图所示。下列说法正确的是( )。

A. 温度:T1>T2>T3
B. 正反应速率:v(b)>v(d) v(a)>v(c)
C. 平衡常数:K(a)>K(c) K(b)=K(d)
D. 平均摩尔质量:M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热ΔH=-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2x(-57.3)kJ·mol-1
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH=a,2C(s)+O2(g)=2CO(g) ΔH=b,则a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去CO2气体中混有的SO2气体,下列有关仪器和药品的组合中,合理的是
①洗气瓶 ②干燥管 ③固态生石灰 ④苏打溶液 ⑤小苏打溶液
A. ①⑤ B. ②⑤ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的说法中,正确的是( )
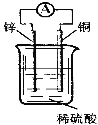
A. 铜片上发生氧化反应
B. 电子由铜片通过导线流向锌片
C. 该装置能将化学能转化为电能
D. 锌片是该装置的正极,该电极反应为Zn+2e—==Zn2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com