
【题目】化合物I可用于某种高分子的接枝,其一种合成路线如下:
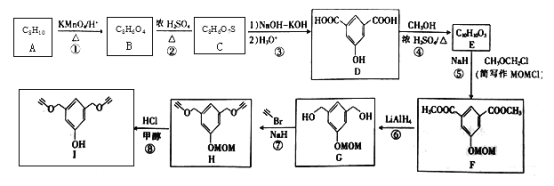
回答下列问题:
(1)A的化学名称是_______________________。
(2)②的反应类型是______________________。
(3)C的结构简式为_________________;H的分子式为__________________。
(4)F中含氧官能团的名称是___________。
(5)芳香化合物W是E的同分异构体,W能发生水解反应和银镜反应,核磁共振氢谱有四组峰,面积比为1︰1︰2︰6,写出一种符合要求的W的结构简式:___________。
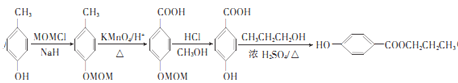
(6)尼泊金丙酯(HO-![]() -COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
-COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
【答案】间二甲苯(或1,3-二甲苯) 取代反应 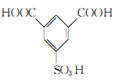 C10H14O4 酯基和醚键
C10H14O4 酯基和醚键 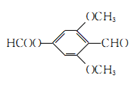 或
或 或
或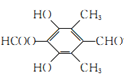 或
或
【解析】
由流程图A为间二甲苯,A为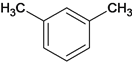 ,A被高锰酸钾氧化为B,B为
,A被高锰酸钾氧化为B,B为 ,B与浓硫酸发生取代反应生C,C为
,B与浓硫酸发生取代反应生C,C为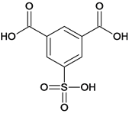 ,C经反应③生成D,D为
,C经反应③生成D,D为 ,D发生酯化反应生成E,E为
,D发生酯化反应生成E,E为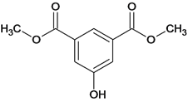 ,E发生反应⑤取代后生成F,F为
,E发生反应⑤取代后生成F,F为 ,F还原成G,G为
,F还原成G,G为 ,G与溴乙炔生成H,H为
,G与溴乙炔生成H,H为 ,H在HCl作用下,生成I,I为
,H在HCl作用下,生成I,I为 。
。
(1)A为 ,化学名称是:间二甲苯(或1,3-二甲苯);
,化学名称是:间二甲苯(或1,3-二甲苯);
(2)B的苯环上的氢被磺酸基所取代,发生取代反应生成C;
(3)C的结构简式为: ;H为
;H为 ,分子式为:C10H14O4;
,分子式为:C10H14O4;
(4)F为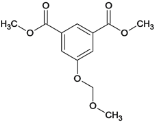 ,含氧官能团的名称是酯基和醚键;
,含氧官能团的名称是酯基和醚键;
(5)芳香化合物W是E 的同分异构体,W能发生水解反应和银镜反应,含醛基和酯基,核磁共振氢谱有四组峰,面积比为1︰1︰2︰6,结构中可能含有2个甲基,符合要求的W的结构简式:
的同分异构体,W能发生水解反应和银镜反应,含醛基和酯基,核磁共振氢谱有四组峰,面积比为1︰1︰2︰6,结构中可能含有2个甲基,符合要求的W的结构简式: 或
或 或
或 或
或 。
。
(6)以对甲苯酚和1-丙醇为起始原料,合成尼泊金丙酯(HO-![]() -COOCH2 CH2 CH3),可以先利用题中信息将酚羟基保护起来,再将甲基氧化成羧基,接着把酚羟基复原,最后与丙醇发生酯化。具体合成路线如下:
-COOCH2 CH2 CH3),可以先利用题中信息将酚羟基保护起来,再将甲基氧化成羧基,接着把酚羟基复原,最后与丙醇发生酯化。具体合成路线如下:


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】近年来有多个品牌的手机电池曾发生爆炸事故,公众对电池安全性的重视程度越来越高,燃料电池作为安全性能较好的一类化学电源得到了更快的发展。 一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,工作时产生稳定无污染的物质。下列说法不正确的是( )
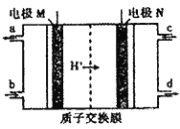
A. M极生成氮气且电极附近溶液酸性增强
B. 负极上每消耗1molN2H4,会有4molH+通过质子交换膜
C. 正极的电极反应式为:O2+4H++4e-=2H2O
D. d口流出的液体是蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导滴定是利用溶液的电导改变以确定滴定终点的滴定方法。常温下,将0.10mol·L-1CH2COOH溶液与0.10mo1·L-1HCl溶液以一定体积比混合,用0.10mol·L-1NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是

A. a点溶液的pH=1
B. b点溶液中:c(Na+)=c(Clˉ)+c(CH3COOˉ)
C. 图中四点,C点处溶液中水的电离度最大
D. d点溶液中:c(Na+)>c(Clˉ)>c(CH3COOˉ)>c(OHˉ)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. 己二酸电离常数Ka1(H2X)约为10-4.4
B. 曲线M表示pH与![]() 的变化关系
的变化关系
C. 当溶液中c(X2—)=c(HX—)时,溶液为碱性
D. 当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
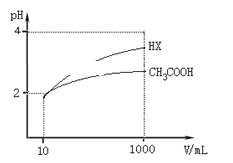
则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
CH3OH(g) H=-99kJmol-1中的相关化学键键能如下:
则x=___________。
化学键 | H-H | C-O | C三O | H-O | C-H |
E/(kJmol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
CH3OH(g) H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如下图所示。
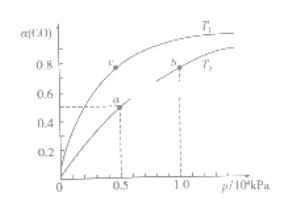
①T1_________T2(填“>”、“<”、“=”);a、b两点的反应速率:v(a)_____v(b)(填“>”、“<”、“=”);
在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_____(填字母);
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
C.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
②计算图中a点的平衡常数KP=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
a:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
b:CO2(g)+H2(g)![]() CO(g)+H2O(g) H2
CO(g)+H2O(g) H2
c:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H3
CH3OH(g)+H2O(g) H3
①述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
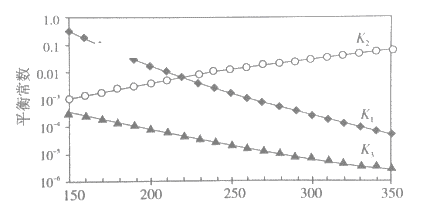
则H1__________H3(填“>”、“<”、“=”),理由是_______。
②一定温度下,在3 L容积可变的密闭容器中发生反应b,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________;当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_________。
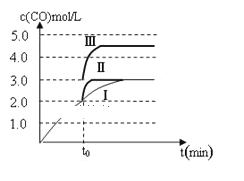
③反应c的 △H___0, △S____0(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化物不溶于水,但溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A.Al2O3B.MgOC.SiO2D.P2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表离子中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32- |
实验I :取少量该试液进行如下实验。
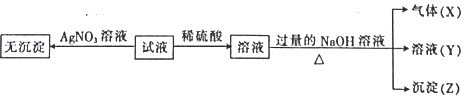
实验Ⅱ:为了进一步确定该溶液的组成,取100 mL原溶液,向该溶液中滴加1 mol L-l的 NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有___________种。
(2)通过实验I可以确定该溶液中一定存在的阴离子是_____________。检验气体X的方法是______________________;沉淀Z的化学式为_________________。
(3)写出实验Ⅱ的图象中BC段对应的离子方程式:_____________________________________。
(4) A点对应的固体质量为__________g。
(5)通过上述信息,推算该溶液中阴离子的浓度为______________mol L-l。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向2L密闭容器中通入amol气体A,在一定条件下发生反应:xA(g)![]() yB(g)+pC(g)+qD(g)。已知:平均反应速率
yB(g)+pC(g)+qD(g)。已知:平均反应速率![]() ;反应至2min时,A的物质的量减少为起始时的
;反应至2min时,A的物质的量减少为起始时的![]() ,生成B、D的物质的量分別为
,生成B、D的物质的量分別为![]() a mol、a mol。回答下列问题:
a mol、a mol。回答下列问题:
(1)0~2min内,![]() __________________。
__________________。
(2)该反应的化学方程式为_________________________________________。
(3)反应xA(g)![]() yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
yB(g)+pC(g)+qD(g)达到化学平衡状态的标志是________(填序号)。
①A(g)的消耗速率与C(g)的生成速率之比为x:p
②A(g)的物质的量保持恒定
③A(g)的消耗速率与D(g)的消耗速率之比为q:x
④B(g)和C(g)的物质的量之比为y:p
(4)若A、B的起始浓度分别为m mol/L、n mol/L(C、D的起始浓度均为0),反应达到平衡时,A、B的浓度分别为0.5 mol/L、0.1 mol/L,则m、n应满足的关系为__________(用含m、n的等式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com