
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
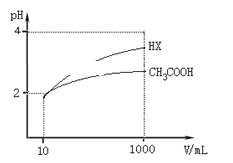
则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
【答案】增大 a>b>d>c cd b > > > 9.9×10-7 moL·L-1
【解析】
(1)升高温度促进弱电解质的电离;
(2)酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱;
(3)酸性强弱为CH3COOH > H2CO3> HClO > HCO3-,强酸能够制取弱酸,据此对各选项进行判断;
(4)醋酸是弱电解质,加水稀释醋酸,促进醋酸电离,则n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,但醋酸根离子、氢离子浓度增大的程度小于溶液体积增大的程度,所以n(CH3COO-)、n(H+)、n(CH3COOH)都减小,据此分析解答;
(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大;酸性不同的两种一元弱酸,体积相同,pH相同,酸越弱,浓度越大,中和时消耗的氢氧化钠越多;
(6)根据混合液中的电荷守恒计算。
(1)升高温度促进弱电解质的电离,所以当温度升高时,Ka增大;
因此,本题正确答案是:增大;
(2)电离平衡常数越大,越易电离,溶液中离子浓度越大,则酸性强弱为:CH3COOH > H2CO3> HClO > HCO3-,酸根离子对应的酸的酸性越强,酸根离子结合氢离子的能力越弱,则四种离子结合质子的能力由大到小的顺序是:CO32->ClO- >HCO3- >CH3COO- ,即a>b>d>c,
因此,本题正确答案是:a>b>d>c;
(3) a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O:碳酸的酸性小于CH3COOH,所以CH3COOH能够制取碳酸,该反应能够发生,故a错误;
b. ClO-+CH3COOH=CH3COO-+HClO:CH3COOH的酸性大于HClO,CH3COOH能够制取HClO,该反应能够发生,故b错误;
c. CO32-+2HClO=CO2↑+H2O+2ClO-:HClO的酸性小于碳酸,该反应无法发生,故c正确;
d. 2ClO-+CO2+H2O=CO32-+2HClO:因为酸性H2CO3> HClO > HCO3-,则碳酸与次氯酸根离子反应只能生成碳酸氢根离子,不会生成CO32-,该反应不能发生,故d正确;
因此,本题正确答案是:cd;
(4)a.加水稀释醋酸促进醋酸电离,氢离子物质的量增大,醋酸分子的物质的量减小,所以![]() 的比值减小,故a错误;
的比值减小,故a错误;
b.加水稀释醋酸促进醋酸电离,醋酸根离子物质的量增大,醋酸分子的物质的量减小,则![]() 的比值增大,故b正确;
的比值增大,故b正确;
c.加水稀释促进醋酸电离,但氢离子浓度减小,温度不变,水的离子积常数不变,所以![]() 的比值减小,故c错误;
的比值减小,故c错误;
d.加水稀释醋酸促进醋酸电离,氢离子浓度减小,温度不变,水的离子积常数不变,则氢氧根离子浓度增大,![]() 的比值减小,故d错误;
的比值减小,故d错误;
因此,本题正确答案是:b;
(5)加水稀释促进弱酸电离,pH相同的不同酸稀释相同的倍数,pH变化大的酸酸性强,变化小的酸酸性弱;酸或碱抑制水电离,酸中氢离子或碱中氢氧根离子浓度越大其抑制水电离程度越大,根据图知,pH相同的醋酸和HX稀释相同的倍数,HX的pH变化大,则HX的酸性大于醋酸,所以HX的电离平衡常数大于数,稀释后醋酸中氢离子浓度大于HX,所以醋酸抑制水电离程度大于HX,则HX溶液中水电离出来的c(H+)大于醋酸溶液水电离出来c(H+);酸性不同的两种一元弱酸,体积相同,pH相同,酸越弱,浓度越大,中和时消耗的氢氧化钠越多,因酸性HX大于醋酸,所以恰好中和时消耗NaOH溶液的体积:醋酸大于HX;
因此,本题正确答案是:>;>;>;
(6)pH=6,则c(H+)=10-6mol/L、c(OH-)=10-8mol/L,
溶液呈存在电荷守恒:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),
则:c(CH3COO-)- c(Na+)=c(H+)-c(OH-) =10-6mol/L-10-8mol/L=9.9×10-7mol/L,
因此,本题正确答案是:9.9×10-7mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,试回答以下问题:
Ⅰ.实验室用以下装置进行实验
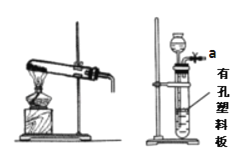
甲 乙
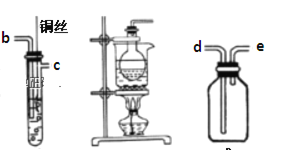
丙 丁 戊
(1)装置甲和戊用于制取并收集少量氨气,甲中发生反应的化学方程式为:_________。 戊装置收集氨气应从收集装置的_________(填字母序号)导管进气。
(2)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中 盛满稀NaOH溶液,仪器正确的连接顺序为_________ (用接口字母表示)。
Ⅱ 无水三氯化铁呈棕红色,易潮解,100℃左右时升华,冷却后易凝华。如图是两名学生设计的用氯气与铁反应制备无水三氯化铁的实验装置。左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示。试回答:
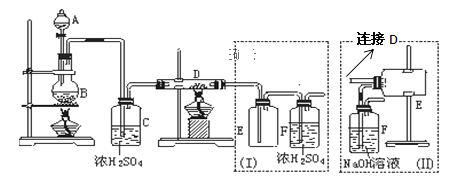
(3)B中反应的化学方程式为_______________________;其中浓盐酸表现出______性。
(4)D中的反应开始前,需进行的操作是_______________,应采取的方法是______________________。
(5)D中发生反应的化学方程式为_____________________________________________。
(6)装置(Ⅰ)的主要缺点是_________________________________________。
(7)装置(Ⅱ)中F中发生反应的化学方程式为___________________。如果选用(Ⅱ)装置来完成实验,则必须采取的改进措施是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2 ![]() 2NO+O2(正反应吸热)。实验测得:
2NO+O2(正反应吸热)。实验测得:![]() ,
,![]() ,
,![]() 为速率常数,受温度影响。 下列说法正确的是
为速率常数,受温度影响。 下列说法正确的是

A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中![]() 的体积分数大于50%
的体积分数大于50%
D. 当温度改变为![]() 时,若
时,若![]() ,则
,则 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、硅及其化合物用途非常广泛。回答下列问题:
(1)基态Si原子价层电子的电子排布图(轨道表达式)为__________,基态Mg原子电子占据最高能级的电子云轮廓图为__________形。
(2)Mg2C3与水反应可生成H2C=C=CH2,中间的碳原子杂化方式是__________,反应所涉及的元素中电负性最大的是__________(填元素符号),Mg2C3和H2C=C=CH2中均存在(填字母)__________。
A.配位键 B.σ键 C.π键 D.氢键
(3)MgO晶格能可通过图1的bom- Haber循环计算得到。
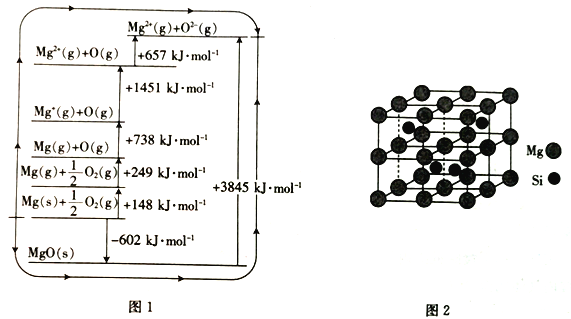
Mg的第二电离能为__________kJ·mol-1;O=O键的键能为_________kJ·mol-1;MgO的晶格能为__________kJ·mol-1。
(4)Mg2Si晶胞结构如图2所示,已知其密度为1.94g·cm-3,NA为阿伏加德罗常数的值。
①则晶胞参数a=__________nm(列出计算式)
②Mg2Si的另一种表示中,四个Mg处于上图所示立方体中的Si的位置,则Si处于____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物I可用于某种高分子的接枝,其一种合成路线如下:
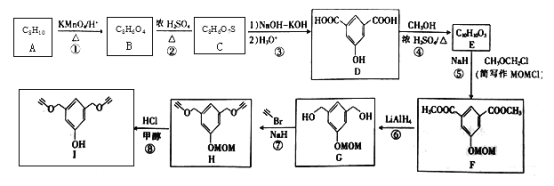
回答下列问题:
(1)A的化学名称是_______________________。
(2)②的反应类型是______________________。
(3)C的结构简式为_________________;H的分子式为__________________。
(4)F中含氧官能团的名称是___________。
(5)芳香化合物W是E的同分异构体,W能发生水解反应和银镜反应,核磁共振氢谱有四组峰,面积比为1︰1︰2︰6,写出一种符合要求的W的结构简式:___________。
(6)尼泊金丙酯(HO-![]() -COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
-COOCH2 CH2 CH3)用作食品、化品、饲料等的防腐剂,设计由对甲苯酚和1-丙醇为起始原料制备尼泊金丙酯的合成路线:______________________(其他试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) ![]() H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
H2(g)+I2(g)达到平衡时,c(H2)=1 mol·L-1,c(HI)=4 mol·L-1,则此温度下反应①的平衡常数为( )
A. 36 B. 24 C. 16 D. 9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造骨是一种新型的无机非金属材料,它类似于人骨和天然牙的性质结构,这是利用了这类材料的生物特性。人造骨可以依靠从人体体液中补充某些离子而形成新骨,可在骨骼界面产生分解、吸收、析出等反应,实现骨骼的牢固结合。人造骨植入人体内需要吸收人体中哪些离子才可以形成新骨( )
A. Ca2+ B. Cl- C. Na+ D. PO43-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com