
【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2 ![]() 2NO+O2(正反应吸热)。实验测得:
2NO+O2(正反应吸热)。实验测得:![]() ,
,![]() ,
,![]() 为速率常数,受温度影响。 下列说法正确的是
为速率常数,受温度影响。 下列说法正确的是

A. 达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为 4∶5
B. 达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C. 达平衡时,容器Ⅲ中![]() 的体积分数大于50%
的体积分数大于50%
D. 当温度改变为![]() 时,若
时,若![]() ,则
,则 ![]()
【答案】D
【解析】
根据反应方程式和容器Ⅰ中O2的平衡浓度可知:平衡时,c(NO)=0.4mol/L,c(NO2)=0.2mol/L,则T1温度下,该反应的平衡常数K=![]() =
=![]() =0.8。以此解答。
=0.8。以此解答。
A项,平衡时,容器Ⅰ中气体总物质的量为0.8mol,容器Ⅱ中,气体起始总物质的量为1mol,此时![]() =
=![]() <K,反应正向进行,气体物质的量增大,气体起始总物质的量大于1mol,则达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于4:5,故A项错误。
<K,反应正向进行,气体物质的量增大,气体起始总物质的量大于1mol,则达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于4:5,故A项错误。
B项,根据分析可知:平衡时,容器Ⅰ中![]() =1。当容器Ⅱ中
=1。当容器Ⅱ中![]() =1时,c(NO)=(0.5+
=1时,c(NO)=(0.5+![]() )mol/L,c(NO2)= (0.2+
)mol/L,c(NO2)= (0.2+![]() )mol/L,c(O2)= (0.2+
)mol/L,c(O2)= (0.2+![]() )mol/L,此时
)mol/L,此时![]() 1.38>K,反应逆向进行,则
1.38>K,反应逆向进行,则![]() <1,即达平衡时,容器Ⅱ中
<1,即达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的小,故B项错误。
比容器Ⅰ中的小,故B项错误。
C项,如果III中NO和氧气完全转化为二氧化氮,则c(NO2)=0.5mol/L,且容器中还有c(O2)=0.1mol/L剩余,与I相比,III是相当于增大压强,平衡逆向移动,二氧化氮和氧气之和所占体积比大于50%,则达平衡时,容器Ⅲ中NO的体积分数小于50%,,故C项错误。
D项,![]() ,
,![]() ,达到平衡状态时正逆反应速率相等,则
,达到平衡状态时正逆反应速率相等,则![]() =
=![]() ,且
,且![]() ,则
,则![]() =
=![]() ,化学平衡常数K等于1,该温度下的K大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以
,化学平衡常数K等于1,该温度下的K大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以![]() ,故D正确。
,故D正确。
综上所述,本题正确答案为D。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g) ![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
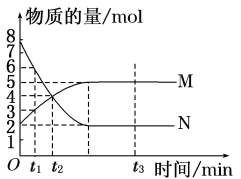
(1)此反应的化学方程式中a∶b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________________________________________________________________________。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,试写出该腐蚀过程中的电极反应式:负极________;正极________。
(2)为了减缓某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填序号)。
A.铜 B.钠
C.锌 D.石墨
(3)图乙所示的方案也可以减缓铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
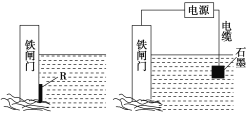
图甲 图乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导滴定是利用溶液的电导改变以确定滴定终点的滴定方法。常温下,将0.10mol·L-1CH2COOH溶液与0.10mo1·L-1HCl溶液以一定体积比混合,用0.10mol·L-1NaOH溶液滴定,滴定曲线如图所示。下列说法正确的是

A. a点溶液的pH=1
B. b点溶液中:c(Na+)=c(Clˉ)+c(CH3COOˉ)
C. 图中四点,C点处溶液中水的电离度最大
D. d点溶液中:c(Na+)>c(Clˉ)>c(CH3COOˉ)>c(OHˉ)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是

A. 己二酸电离常数Ka1(H2X)约为10-4.4
B. 曲线M表示pH与![]() 的变化关系
的变化关系
C. 当溶液中c(X2—)=c(HX—)时,溶液为碱性
D. 当混合溶液呈中性时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
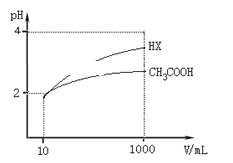
则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化物不溶于水,但溶于熔化的NaOH中,生成易溶于水的化合物,向稀盐酸中滴加所生成化合物的水溶液,立即有白色沉淀产生,则原氧化物是( )
A.Al2O3B.MgOC.SiO2D.P2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系。下列推断不合理的是

A. X可能是一种氢化物
B. Y可能直接转化为E
C. Y不可能转化为X
D. 若X是单质,则X转化为Y的反应可能是化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com