
����Ŀ��һ���¶��£����ݻ�ΪV L���ܱ������н��з�Ӧ��aN(g) ![]() bM(g)��M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
bM(g)��M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ��
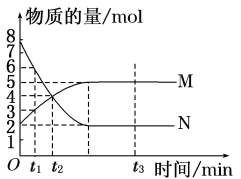
��1���˷�Ӧ�Ļ�ѧ����ʽ��a��b��________��
��2��t1��t2ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ________��
��3��������������˵��������Ӧ�ﵽƽ��״̬����________________________________________________________________________��
A.��Ӧ��M��N�����ʵ���֮��Ϊ1��1
B.������������������ʱ��ı仯���仯
C.�������������ʵ�������ʱ��ı仯���仯
D.��λʱ��������a mol N��ͬʱ����b mol M
E.��������ѹǿ����ʱ��ı仯���仯
F.N��ת���ʴﵽ����ұ��ֲ���
���𰸡�2��1![]() mol��L��1��min��1C��E��F
mol��L��1��min��1C��E��F
��������
��1���μӷ�Ӧ��N�����ʵ���Ϊ8mol-2mol=6mol�����ɵ�M�����ʵ�����5mol-2mol=3mol�����Դ˷�Ӧ�Ļ�ѧ����ʽ��![]() =2��1���ʴ�Ϊ��2��1��
=2��1���ʴ�Ϊ��2��1��
��2����ͼ��֪��t1��t2ʱ��M�����ʵ����仯Ϊ4mol-3mol=1mol����v��M��=![]() =
=![]() mol/��Lmin�����ʴ�Ϊ��
mol/��Lmin�����ʴ�Ϊ��![]() mol/��Lmin����
mol/��Lmin����
��3��A��ƽ��ʱ��Ӧ��������ֵ����ʵ������䣬������ֵ����ʵ�����һ����ȣ���A����B����������������ʼ�ղ��䣬����������������䲻��˵������ƽ�⣬��B����C������a��b���淴Ӧ���л�����������ʵ��������仯���������������ʵ�������ʱ��ı仯���仯��˵������ƽ�⣬��C��ȷ��D����λʱ��������amolN��ͬʱ����bmolM������ʾ����Ӧ���ʣ���Ӧʼ�հ��˹�ϵ���У�����˵������ƽ�⣬��D����E��N�����������ڻ�������б��ֲ��䣬˵�����淴Ӧ���������ƽ��״̬����E��ȷ��F��N��ת���ʴﵽ����ұ��ֲ��䣬˵�����淴Ӧ���������ƽ��״̬����F��ȷ���ʴ�Ϊ��CEF��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ��������ͼ��ʾ������ T ������������������������ȡ������жϲ���ȷ����
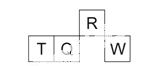
A. �����̬�⻯������ȶ��ԣ�R > Q
B. ����������Ӧˮ��������ԣ�Q < W
C. ԭ�Ӱ뾶��T > Q > R
D. �� T ������Һһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������п��a��b���ֱ������֧��ͬ���Թ��У�Ȼ��������������ʵ���Ũ���Ҿ�������ϡ���ᣬͬʱ��a�м�������CuSO4��Һ����������������(V)��ʱ��(t)�Ĺ�ϵ��ͼ���ʾ���£�������ȷ����(����)
A. 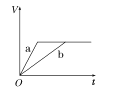 B.
B. 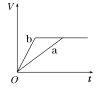 C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ҹ������������������������Ҫԭ����SO2��NOx�Ȼӷ����л���ȷ�������ת�����о�̼���������仯�����ת�����ڻ����ĸ������ش����塣
��1����һ�������£�CH4����NOx��Ӧ��ȥNOx����֪�������Ȼ�ѧ����ʽ��
��CH4(g)��2O2(g)��CO2(g)��2H2O(l) ��H��-890.3 kJ��mol-1
��N2(g)��2O2(g)![]() 2NO2(g) ��H��+67.0 kJ��mol-1
2NO2(g) ��H��+67.0 kJ��mol-1
��H2O(g)��H2O(l) ��H��-41.0 kJ��mol-1
��CH4(g)��2NO2(g) ![]() CO2(g)��2H2O(g)��N2 (g) ��H��____kJ��mol-1���÷�Ӧ��____�����£����£��κ��¶ȣ��¿��Է�����
CO2(g)��2H2O(g)��N2 (g) ��H��____kJ��mol-1���÷�Ӧ��____�����£����£��κ��¶ȣ��¿��Է�����
��2��SO2�����������������Ͻ��д���������ȡ���ᣬ����SO2�����������ķ�ӦΪ�� 2SO2(g)+O2(g) ![]() 2SO3(g) ��H< 0����һ���¶��µĶ��������У���˵������ƽ��ﵽƽ��״̬���ǣ�_____________��
2SO3(g) ��H< 0����һ���¶��µĶ��������У���˵������ƽ��ﵽƽ��״̬���ǣ�_____________��
A. ���������ܶȲ��ٷ����仯 B.��������ƽ��Ħ���������ٷ����仯
C. ![]() (SO2):
(SO2):![]() (O2):
(O2):![]() (SO3)=2:1:2 D.�������������ʵ������ٷ����仯
(SO3)=2:1:2 D.�������������ʵ������ٷ����仯
��3������T1�桢0.1 MPa�����£���һ�ܱ�����ͨ��SO2��O2 [����n(SO2)��n(O2)= 2:1]�������������ѹǿ�뷴Ӧʱ������ͼ��ʾ��
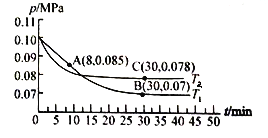
��ͼ��A��ʱ��SO2��ת����Ϊ________��
���������������������£����T2��ʱѹǿ�ı仯������ͼ��ʾ����C�������Ӧ����![]() 0(��)��A����淴Ӧ����
0(��)��A����淴Ӧ����![]() A(��)�Ĵ�С��ϵΪ
A(��)�Ĵ�С��ϵΪ![]() 0(��)_____
0(��)_____![]() A(��) (�>"����<���� = ��)��
A(��) (�>"����<���� = ��)��
��ͼ��B���ƽ�ⳣ��Kp=______��(Kp=ѹǿƽ�ⳣ������ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)
��4��Ϊ�����NO��NO2��N2O4�Դ�������Ⱦ������������������Һ�������մ�����������a mol NO��b molNO2��c molN2O4��ɵĻ������ǡ�ñ�VL����������Һ���գ�������ʣ�ࣩ���������������Һ�����ʵ���Ũ����СΪ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����λ��Ϊ6��Co3���������CoClm��nNH3����1mol����������AgNO3��������1molAgCl��������m��n��ֵ��
A.m��1��n��5B.m��3��n��4
C.m��5��n��1D.m��4��n��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�д���һЩ�غ��ƽ��ԭ��������������ȷ����
A. ��������(ԭ��)�غ㶨�ɣ�ij������ȫȼ�յIJ�����CO2��H2O�������һ������
B. ���������غ㶨�ɣ����л�ѧ��Ӧ�ķ�Ӧ���������һ�������������������
C. ���ݵ����غ㶨�ɣ�ԭ����и�����Ӧʧ������һ������������Ӧ�õ�����
D. ���ݻ�ѧƽ��ԭ�������淴Ӧ������Ӧ�������κ�ʱ��һ�������淴Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��һ����ʵ��Ϊ������ѧ�ƣ��Իش��������⣺
��ʵ����������װ�ý���ʵ��
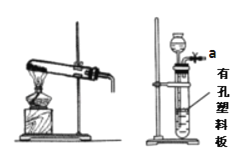
�� ��
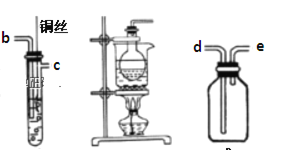
�� �� ��
��1��װ�ü���������ȡ���ռ��������������з�����Ӧ�Ļ�ѧ����ʽΪ��_________�� ��װ���ռ�����Ӧ���ռ�װ�õ�_________������ĸ��ţ����ܽ�����
��2��ѡ��װ���ҡ��������Ʊ����ռ�һ���������壬�������ϰ���������ʯ��ʯ������ ʢ��ϡNaOH��Һ��������ȷ������˳��Ϊ_________ ���ýӿ���ĸ��ʾ����
�� ��ˮ���Ȼ������غ�ɫ���׳��⣬100������ʱ��������ȴ������������ͼ������ѧ����Ƶ�������������Ӧ�Ʊ���ˮ���Ȼ�����ʵ��װ�á���ߵķ�Ӧװ����ͬ�����ұߵIJ�Ʒ�ռ�װ����ͬ���ֱ��磨�ͣ�����ʾ���Իش�
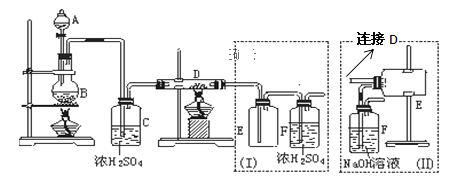
��3��B�з�Ӧ�Ļ�ѧ����ʽΪ_______________________������Ũ������ֳ�______�ԡ�
��4��D�еķ�Ӧ��ʼǰ������еIJ�����_______________��Ӧ��ȡ�ķ�����______________________��
��5��D�з�����Ӧ�Ļ�ѧ����ʽΪ_____________________________________________��
��6��װ�ã�����Ҫȱ����_________________________________________��
��7��װ�ã�����F�з�����Ӧ�Ļ�ѧ����ʽΪ___________________�����ѡ�ã���װ�������ʵ�飬������ȡ�ĸĽ���ʩ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ���ң�����ܷ�ӦΪ��2Cu��H2O![]() Cu2O��H2��������˵����ȷ����
Cu2O��H2��������˵����ȷ����
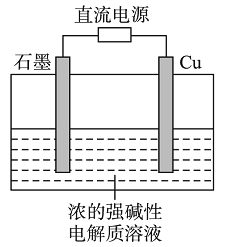
A. ʯī�缫�ϲ�������
B. ͭ�缫������ԭ��Ӧ
C. ͭ�缫��ֱ����Դ�ĸ���
D. ����0.1 mol����ת��ʱ����0.1 mol Cu2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT1ʱ���������ݻ���Ϊ1L�ĺ����ܱ������н�������Ӧ: 2NO2 ![]() 2NO+O2(����Ӧ����)��ʵ����:
2NO+O2(����Ӧ����)��ʵ����:![]() ��
��![]() ��
��![]() Ϊ���ʳ��������¶�Ӱ�졣 ����˵����ȷ����
Ϊ���ʳ��������¶�Ӱ�졣 ����˵����ȷ����

A. ��ƽ��ʱ�����������������е���ѹǿ֮��Ϊ 4��5
B. ��ƽ��ʱ����������![]() ���������еĴ�
���������еĴ�
C. ��ƽ��ʱ����������![]() �������������50%
�������������50%
D. ���¶ȸı�Ϊ![]() ʱ����
ʱ����![]() ����
���� ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com