
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是()

A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下图所示A、B、C、D四种仪器,写出名称:
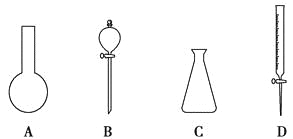
A. ,B. ,
C. ,D. 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺,可使仪器不漏液或不漏气。在下列仪器中:①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶;⑦酸式滴定管;⑧碱式滴定管,肯定用不到“磨砂”处理的有 (填序号)。
(3)以下是中学化学实验中常见的定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平
①其中标有仪器使用温度的是 (填编号)。
②实验时用来精确量取液体体积的是 (填编号)。
③使用前要检查仪器是否漏液的是 (填编号)。
(4)玻璃棒的作用主要有以下四种:①搅拌、②引流、③蘸取溶液、④转移固体。不同实验中其作用可能不完全相同,请回答下列问题:
A.在“用无水碳酸钠配制100 mL 0.12 mol·L-1的碳酸钠溶液”的实验中,玻璃棒的作用是 (填写编号)。
B.在“用氢氧化钠溶液、碳酸钠溶液、氯化钡溶液、盐酸、水等试剂除去粗盐中的Mg2+、Ca2+、SO42-等杂质离子以制得纯净的食盐”的实验中玻璃棒的作用可能是 (填写编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)向偏铝酸钠溶液中滴入1~2滴酚酞溶液,溶液显____色,用离子方程式表示原因________。
(2)Fe(OH)3胶体可用作净水剂,取少量Fe(OH)3胶体于试管中,向试管中逐渐滴加稀盐酸至过量,现象为_________________________
(3)已知:5NH4NO3![]() 2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为______。
2HNO3+4N2↑+9H2O,则该反应中氧化产物与还原产物的质量比为______。
(4)有机物CH3CH(C2H5)CH(C2H5)CH(CH3)2系统命名法命名为 ______________________
(5)邻甲基苯甲酸( )有多种同分异构体,其中属于酯类,但分子结构中含有甲基和苯环的异构体有____________种
)有多种同分异构体,其中属于酯类,但分子结构中含有甲基和苯环的异构体有____________种
(6)甲酸和甲醇发生酯化反应方程式______________________________________________
(7)![]() 与足量NaOH溶液反应的化学方程式______________;
与足量NaOH溶液反应的化学方程式______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如图实验:

现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的![]() 置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是__________________________________。
(2)装置a和c的作用分别是________和________(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)滴定达终点时的现象是_________________________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_______________________。
(5)通过计算可知,该黄铜矿的纯度为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在加热条件下,用二氧化锰与足量浓盐酸反应,制得氯气0.56L(标准状况)。问:
(1)理论上需要消耗MnO2的质量为__________。
(2)被氧化的HCl的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列是有关R、W、X、Y、Z五种元素的叙述,其中正确的是
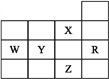
A. X元素是电负性最大的元素
B. p能级未成对电子最多的是Z元素
C. Y、Z的阴离子电子层结构都与R原子的相同
D. W元素的第一电离能小于Y元素的第一电离能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅、铜、镓、硒等化学物质可作为制造太阳能电池板的材料。
(1)镓是ⅢA族元素,写出基态镓原子的核外电子排布式__________________。
(2)硒为第四周期ⅥA族元素,与其相邻的元素有砷(33号)、溴(35号),则三种元素的电负性由大到小的顺序为______________(用元素符号表示)。
(3)SeO3分子的立体构型为____,与硒同主族元素的氢化物(化学式为H2R)中,沸点最低的物质化学式为____。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的关系如图所示,呈现这种变化的原因是____________。

(5)金属铜投入氨水中或投入过氧化氢溶液中均无明显现象,但投入氨水与过氧化氢的混合液中,则铜片溶解,溶液呈深蓝色,写出使溶液呈深蓝色的离子的化学式_____。
(6)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数之比为____________,若该晶体的晶胞边长为a pm,则该合金的密度为________________g·cm-3(列出计算式,不要求计算结果,设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,亚砷酸(H3AsO3)水溶液中含砷的各物种的分布分数(平衡时某物种的物质的量浓度占各物种的物质的量浓度之和的分数)与pH的关系如图所示。下列说祛正确的是

A. 以酚酞为指示剂,用NaOH溶液滴定到终点时发生的主要反应为H3AsO3+2OH-==HasO32-+H2O
B. pH=11时,溶液中有c(H2AsO3-)+2c(HAsO32-)+c(OH-)=c(H+)
C. 若将亚砷酸溶液加水稀释,则稀释过程中c(HAsO32-)/ c(H2AsO3-)减小
D. Ka1(H3AsO3)的数量级为10-10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com