
【题目】黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,甲同学设计了如图实验:

现称取研细的黄铜矿样品1.84 g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的![]() 置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
置于锥形瓶中,用0.05 mol·L-1 标准碘溶液进行滴定,消耗标准溶液20 mL。
请回答下列问题:
(1)将样品研细后再反应,其目的是__________________________________。
(2)装置a和c的作用分别是________和________(填标号,可以多选)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)滴定达终点时的现象是_________________________________________。
(4)上述反应结束后,仍需通一段时间的空气,其目的是_______________________。
(5)通过计算可知,该黄铜矿的纯度为___________________。
【答案】 增大接触面积,加快反应速率;使原料充分反应 bd e 锥形瓶中的溶液由无色变为蓝色且半分钟不褪色 使反应生成的SO2全部进入d装置中,使结果精确 50%
【解析】该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度;
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量;灼热的铜网可以除去多余的氧气;
(3)当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝且半分钟不褪色,证明反应达到反应终点;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:![]() ×100%=50%。
×100%=50%。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法中,正确的一组是
①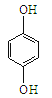 和
和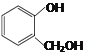 互为同系物
互为同系物
②蛋白质水解和油脂皂化都是高分子生成小分子的过程
③高分子材料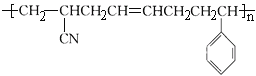 是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性
是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性
④C2H2 和C6H6不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O2和生成的H2O的质量不变
⑤塑料、合成橡胶和合成纤维都是合成高分子材料
⑥棉花、蚕丝、人造丝的主要成分都是纤维素
A. ②③④⑤ B. ①③⑤ C. ④⑤ D. ①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电离平衡常数(K)的说法中正确的是
A. 在一定温度,相同浓度时电离平衡常数(K)越大可以表示弱电解质电离程度越大
B. 电离平衡常数(K)与温度无关
C. 不同浓度的同一弱电解质,其电离平衡常数(K)不同
D. 多元弱酸各步电离平衡常数相互关系为K1<K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗病毒药物的合成中间体的合成路线如下:

请回答下列问题:
(1)X分子中的官能团名称为____________;Y分子的结构简式为_______________。![]() 的一种同分异构体为CH3C≡CCH3,其名称为__________________。
的一种同分异构体为CH3C≡CCH3,其名称为__________________。
(2)在合成路线中①、⑤的反应类型分别为①_____________,⑤______________。
(3)写出反应②、④的化学方程式:反应②____________________________________;
反应④____________________________________。
(4)![]() 具有的性质是__________________(填序号)。
具有的性质是__________________(填序号)。
①能发生取代反应;②能发生加成反应;③能发生中和反应;
④能发生银镜反应;⑤能发生消去反应;
(5)该抗病毒药物的合成中间体有多种同分异构体,能满足下列条件的结构简式为__________________。
①可发生银镜反应,且能与NaHCO3反应生成CO2;②是芳香族化合物;
③核磁共振氢谱显示有4种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是
A. 常温下64 g S4和S8混合物中含有原子数为2NA
B. 标准状况下,22.4LHF中含电子数为10NA
C. 标准状况时,2.24LNO和1.12LO2于密闭容器中充分反应后,其分子数为0.1NA
D. 足量铁在1mol氯气中加热反应,铁失去的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是( )
A. 明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀:Al3++Ba2++SO42-+3OH-=BaSO4↓+Al(OH)3↓
B. 将铁粉加入到稀硫酸种:2Fe+6H+=2Fe3++3H2↑
C. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O
D. NaAlO2溶液中通入过量的CO2:2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质A~F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;在适当的条件下,它们之间可以发生如下图所示的转化。

试回答下列问题:
⑴ A的化学式是____________;
⑵ 反应F→D的化学方程式是______________________________________。
⑶ 检验F中金属阳离子的常用方法是___________________________________。
⑷ 物质B与盐酸反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】
有机高分子化合物G的合成路线如下:

已知:
①A既能与NaHCO3溶液反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱有4个峰。

请回答:
(1)B的名称为________,G中含有的官能团名称为________。
(2)B→C、D→E的反应类型分别为______________、 。
(3)A+E→F的化学方程式为 。
(4)D发生银镜反应的化学方程式为 。
(5)符合下列条件的E的同分异构体有________种(不考虑立体异构),写出其中一种的结构简式 。
( ①含有![]() 结构 ②苯环上有2个取代基 )
结构 ②苯环上有2个取代基 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com